
Structure, propriétés, utilisations de l'oxyde de titane (IV)
le oxyde de titane (IV) est un solide inorganique cristallin blanc dont la formule chimique est TiOdeux, c'est pourquoi il est également connu sous le nom de dioxyde de titane. Il existe sous trois formes cristallines: le rutile, l'anatase et la brookite. Bien que dans la nature, il soit généralement coloré en raison de la présence d'impuretés telles que le fer, le chrome ou le vanadium, TiOdeux pur est utilisé comme pigment blanc.
Parmi ses caractéristiques, nous pouvons souligner que la solubilité du TiOdeux il dépend considérablement de son histoire chimique et thermique. De plus, lorsqu'il est chauffé à des températures élevées (900 ºC), il devient chimiquement inerte. Ses sources les plus importantes sont l'ilménite (oxyde de fer et de titane), le rutile et l'anatase.

Il est produit principalement dans une qualité convenant à une utilisation comme pigment, garantissant ses excellentes propriétés de diffusion de la lumière dans les applications nécessitant une opacité et une brillance du blanc..
Il est également produit sous forme de matériau ultra-fin, pour des applications où la transparence et une absorption maximale des rayons ultraviolets (UV) sont nécessaires. Par exemple, en tant que composant d'un écran solaire pour la peau. Dans ceux-ci, le TiOdeux agit comme un filtre, bloquant ainsi l'absorption de ces rayons.
En raison de son inertie chimique, c'est le pigment blanc préféré. Cependant, la Food and Drug Administration des États-Unis, ou FDA NOUS. Administration des aliments et des médicaments), a établi les paramètres pour son utilisation sûre dans les aliments et les cosmétiques.
Il existe également une limite d'exposition à la poussière d'oxyde de titane, car lorsque la poussière est inhalée, elle peut se déposer dans les poumons..
Index des articles
- 1 Structure
- 1.1 Rutile
- 1.2 Anatase
- 1.3 Brookite
- 2 propriétés
- 2.1 État physique
- 2,2 dureté Mohs
- 2.3 Poids moléculaire
- 2.4 Point de fusion
- 2.5 Densité
- 2.6 Solubilité
- 2,7 pH
- 2.8 Indice de réfraction
- 2.9 Autres propriétés
- 3 Nomenclature
- 4 utilisations
- 4.1 Pigments blancs
- 4.2 Plastiques
- 4.3 Autres utilisations
- 5 Références
Structure
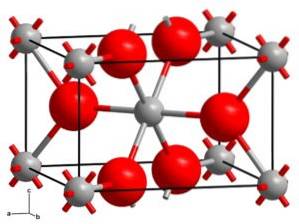
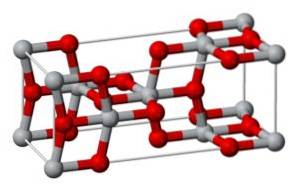
L'oncledeux Il a trois modifications cristallines: le rutile, l'anatase et la brookite. Ces variétés cristallines se trouvent toutes dans la nature.
Rutile
Le rutile cristallise dans le système tétragonal avec deux unités TiOdeux pour chaque cellule. Le titane est coordonné de manière octaédrique. Des études calorimétriques ont montré que le rutile était la forme cristalline la plus stable thermiquement..
Anatase
Cette forme cristallise également dans le système tétragonal, mais l'anatase se présente sous la forme d'octaèdres fortement déformés d'atomes d'oxygène par rapport à chaque atome de titane, deux d'entre eux étant relativement plus proches. Il a 4 unités de TiOdeux pour chaque cellule cristalline.
Brookite
Cristallise dans le système orthorhombique, avec 8 unités TiOdeux pour chaque cellule cristalline.
Propriétés
État physique
Solide cristallin.
Dureté Mohs
Rutile: 7-7,5.
Anatase: 5,5-6.
Poids moléculaire
79,87 g / mol.
Point de fusion
Rutile: 1830-1850 ºC.
Anatase: en chauffant, il devient rutile.
Densité
Rutile: 4 250 g / cm3
Anatase: 4,133 g / cm3
Brookite: 3,895 g / cm3
Solubilité
Insoluble dans l'eau et les solvants organiques. Se dissout lentement dans HF et HdeuxSW4 concentré chaud. Insoluble dans HCl et HNO3.
pH
7,5.
Indice de réfraction
Rutile: 2,75 à 550 nm.
Anatase: 2,54 à 550 nm.
A l'indice de réfraction le plus élevé de tous les pigments inorganiques.
Autres propriétés
L'anatase se transforme rapidement en rutile à des températures supérieures à 700 ° C. L'oncledeux calciné à 900 ºC, il se dissout faiblement dans les bases, l'acide fluorhydrique et l'acide sulfurique chaud. Il n'est pas attaqué par les acides inorganiques faibles ou les acides organiques. Il n'est pas facilement réduit ou oxydé.
L'anatase et le rutile sont des semi-conducteurs à large bande, mais leur conductivité électrique dépend de la présence d'impuretés et de défauts dans le cristal..
Nomenclature
-Dioxyde de titane
-Rutile
-Anatase
-Brookite
-Titania
Applications
Pigments blancs
L'utilisation la plus importante de l'oxyde de titane (IV) est comme pigment blanc dans une grande variété de produits, y compris les peintures, les laques, les adhésifs, les plastiques, le papier et les encres d'imprimerie. Cela est dû à son indice de réfraction élevé et à son inertie chimique..

Le dioxyde de titane utilisé comme pigment blanc doit être de haute pureté. Son opacité et sa luminosité proviennent de sa capacité à diffuser la lumière. C'est plus brillant que le diamant. Seuls le rutile et l'anatase ont de bonnes propriétés de pigmentation.
Plastiques
TiO dans les plastiquesdeux minimise la fragilité et les fissures qui peuvent survenir à la suite d'une exposition à la lumière.
C'est le pigment le plus important dans la fabrication d'articles en plastique PVC pour l'extérieur, car il offre une protection UV au matériau.
La forme cristalline optimale dans ce cas est le rutile. Dans cette application, le rutile doit avoir un revêtement de surface en zirconium, silice ou aluminium, pour minimiser l'effet photocatalytique du TiO.deux dans la dégradation du PVC.
Autres utilisations
D'autres utilisations comprennent les émaux vitreux utilisés sur l'acier et la fonte, auxquels il confère une opacité et une résistance aux acides..
Dans l'industrie textile, il est utilisé dans les guides-fils, de sorte qu'ils glissent facilement pendant le filage. Le frottement entre les fils et les guides génère de l'électricité statique. Pour le dissiper, TiOdeux il doit être brûlé à 1300 ºC, afin d'avoir une conductivité électrique plus élevée.
D'autres applications incluent la pigmentation des encres d'imprimerie, du caoutchouc, des textiles, du cuir, des fibres synthétiques, de la céramique, du ciment blanc, des revêtements de sol et des matériaux de toiture. En tant que revêtement de papier, TiOdeux le rend plus blanc, plus brillant et plus opaque.
Il est utilisé en cosmétique pour aider à couvrir les imperfections de la peau, ainsi que pour rendre le dentifrice et le savon blancs..
Il permet de protéger les aliments, les boissons, les suppléments et les produits pharmaceutiques de la dégradation prématurée produite par l'effet de la lumière, prolongeant la durée de vie du produit.
C'est un composant dans la production de verre, de céramique et d'électrocéramique. Il est utilisé dans les éléments de circuits électriques. Également utilisé dans le capteur d'oxygène du système d'échappement de véhicule automobile.
L'oncledeux Ultrafine est utilisée comme composant de la crème solaire, car elle absorbe fortement les rayons ultraviolets (UV), à la fois UV-A et UV-B. Les rayons UV-A provoquent des rides et le vieillissement de la peau, et les UV-B provoquent des brûlures et un érythème.
Nanoparticules de TiOdeux sont utilisés comme matériau de support pour les catalyseurs de réaction chimique.
L'anatase est un photocatalyseur efficace qui oxyde les composés organiques. Plus ses particules sont petites, plus il est efficace.
Les références
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. John Wiley et fils.
- Kirk-Othmer (1994). Encyclopédie de la technologie chimique. Volume 19 et 24. Quatrième édition. John Wiley et fils.
- Faits sur la sécurité chimique. (2019). Le dioxyde de titane. Récupéré de: Chemicalsafetyfacts.org
- Wypych, George. (2015). Additifs PVC. In PVC Formulary (deuxième édition). Récupéré de sciencedirect.com
- Denning, R. (2009). Valorisation des produits en laine grâce à la nanotechnologie. Dans les progrès de la technologie de la laine. Récupéré de sciencedirect.com
- Bibliothèque nationale de médecine. (2019). Le dioxyde de titane. Récupéré de: pubchem.ncbi.nlm.nih.gov


Personne n'a encore commenté ce post.