
Histoire de l'arsenic, structure, propriétés, utilisations
le arsenic C'est un semi-métal ou métalloïde qui appartient au groupe 15 ou VA du tableau périodique. Il est représenté par le symbole chimique As, et son numéro atomique est 33. Il peut être trouvé sous trois formes allotropiques: jaune, noir et gris; ce dernier étant le seul à avoir une importance industrielle.
L'arsenic gris est un solide cassant d'apparence métallique avec une couleur cristalline d'acier (image ci-dessous). Il perd son éclat lorsqu'il est exposé à l'air, formant de l'oxyde arséneux (AsdeuxOU ALORS3), qui, lorsqu'il est chauffé, dégage une odeur d'ail. En revanche, ses allotropes jaunes et noirs sont respectivement moléculaires et amorphes..

L'arsenic se trouve dans la croûte terrestre associé à de nombreux minéraux. Seule une petite proportion se trouve à l'état natif, mais associée à l'antimoine et à l'argent.
Parmi les minéraux les plus courants dans lesquels l'arsenic se trouve, on trouve les suivants: realgar (As4S4), l'orpiment (commedeuxS3), loellingite (FeAsdeux) et enargite (Cu3Cul4). L'arsenic est également obtenu comme sous-produit de la fusion de métaux tels que le plomb, le cuivre, le cobalt et l'or..
Les composés de l'arsenic sont toxiques, en particulier l'arsine (AsH3). Cependant, l'arsenic a de nombreuses applications industrielles, y compris l'alliage avec du plomb, utilisé dans la fabrication de batteries de voiture, et l'alliage avec du gallium avec diverses utilisations en électronique..
Index des articles
- 1 Histoire de sa découverte
- 2 Structure de l'arsenic
- 2.1 Arsenic jaune
- 2.2 Arsenic noir
- 3 Configuration électronique
- 4 propriétés
- 4.1 Poids moléculaire
- 4.2 Description physique
- 4.3 Couleur
- 4.4 Odeur
- 4.5 Saveur
- 4.6 Point de fusion
- 4.7 Densité
- 4.8 Solubilité dans l'eau
- 4.9 Rayon atomique
- 4.10 Volume atomique
- 4.11 Rayon covalent
- 4.12 Chaleur spécifique
- 4.13 Chaleur d'évaporation
- 4.14 Electronégativité
- 4.15 Énergie d'ionisation
- 4.16 états d'oxydation
- 4.17 Stabilité
- 4.18 Décomposition
- 4.19 Auto-allumage
- 4.20 Dureté
- 4.21 Réactivité
- 5 utilisations
- 5.1 Alliages
- 5.2 Electronique
- 5.3 Agriculture et conservation du bois
- 5.4 Médicinal
- 5.5 Autres utilisations
- 6 Où est?
- 7 Comment obtenez-vous?
- 8 Références
Histoire de sa découverte
Le nom `` arsenic '' vient du latin arsenicum et du grec arsenikon, faisant référence à l'orpiment jaune, qui était la principale forme d'utilisation de l'arsenic par les alchimistes..
L'arsenic, bien avant d'être reconnu comme un élément chimique, était connu et utilisé sous la forme de ses composés. Par exemple, Aristote au 4ème siècle avant JC. a écrit sur le sandarache, une substance que l'on pense maintenant être du sulfure d'arsenic.
Pline l'Ancien et Pedanius Discórides, au 1er siècle après JC, décrit orpiment, un minéral composé d'AsdeuxS3. Au 11ème siècle, trois espèces d'arsenic ont été reconnues: le blanc (comme4OU ALORS4), le jaune (commedeuxS3) et rouge (comme4S4).
L'arsenic en tant qu'élément pur a été observé pour la première fois par Albertus Magnus (1250). Magnus a chauffé le sulfure d'arsenic avec du savon, notant l'apparition d'une substance avec une caractéristique similaire à l'allotrope grisâtre de l'image. Cependant, le premier rapport authentique de son isolement a été publié en 1649 par Johann Schroeder, un pharmacien allemand..
Schroeder a préparé l'arsenic en chauffant son oxyde avec du charbon de bois. Par la suite, Nicolas Lémery a réussi à le produire en chauffant un mélange d'oxyde d'arsenic, de savon et de potasse. Au 18ème siècle, cet élément a finalement été reconnu comme un semi-métal.
Structure de l'arsenic
L'arsenic est isomorphe à l'antimoine; c'est-à-dire qu'ils sont structurellement identiques, ne différant que par la taille de leurs atomes. Chaque atome d'arsenic forme trois liaisons covalentes As-As, de telle sorte qu'elles proviennent d'unités hexagonales As6 «Ridé ou raide», puisque l'hybridation des atomes As est sp3.
Puis les unités comme6 ils se connectent donnant naissance à de fines couches d'arsenic, qui interagissent faiblement les unes avec les autres. En raison de leurs forces intermoléculaires, dépendant surtout de leurs masses atomiques, les cristaux d'arsenic gris rhomboédriques confèrent au solide une texture fragile et cassante..
Peut-être en raison des répulsions de la paire d'électrons libres de l'arsenic, l'As6 formé entre des couches parallèles ne définissent pas un octaèdre parfait mais déformé:
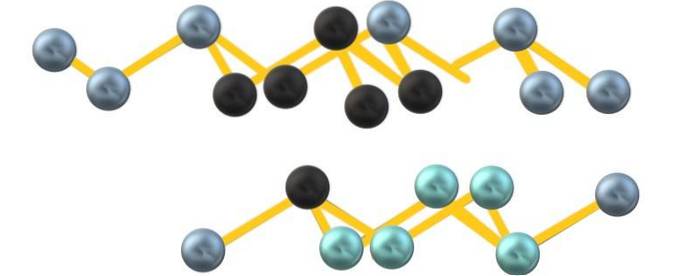
Notez que les sphères noires dessinent le plan déformé dans l'espace entre deux couches raides. De même, dans la couche ci-dessous, il y a des sphères bleuâtres qui, avec la sphère noire, constituent l'unité As6 mentionné au début de la section.
La structure semble ordonnée, les rangées montent et descendent et sont donc cristallines. Cependant, il peut devenir amorphe, les sphères étant comprimées de différentes manières. Lorsque l'arsenic grisâtre devient amorphe, il se transforme en semi-conducteur.
Arsenic jaune
L'arsenic jaune, l'allotrope le plus toxique de cet élément, est un solide purement moléculaire. Il se compose de molécules d'As4 unités par de faibles forces de dispersion, qui ne les empêchent pas de se volatiliser.
Arsenic noir
L'arsenic noir est amorphe; mais pas comment l'allotrope grisâtre peut être. Sa structure est légèrement similaire à celle qui vient d'être décrite, à la différence que ses plans d'unités comme6 ont de plus grandes surfaces et différents modèles de désordre.
Configuration électronique
[Ar] 3ddix4 sdeux4p3
Il a toutes les orbitales de niveau 3 remplies. Forme des liaisons en utilisant les orbitales 4s et 4p (tout comme la 4d) grâce à différentes hybridations chimiques.
Propriétés
Poids moléculaire
74,922 g / mol
Description physique
L'arsenic gris est un solide grisâtre avec un aspect métallique et une consistance cassante..
Couleur
Trois formes allotropes, jaune (alpha), noire (bêta) et grise (gamma).
Odeur
Toilette
Goût
Insipide
Point de fusion
1090 K à 35,8 atm (point triple de l'arsenic).
À pression normale, il n'a pas de point de fusion, car il se sublime à 887 K.
Densité
-Arsenic gris: 5,73 g / cm3.
-Arsenic jaune: 1,97 g / cm3.
Solubilité dans l'eau
Insoluble
Radio atomique
139 heures
Volume atomique
13,1 cm3/ mol
Rayon covalent
120 h
Chaleur spécifique
0,328 J / gmol à 20 ° C
Chaleur d'évaporation
32,4 kJ / mol
Électronégativité
2.18 sur l'échelle de Pauling
Énergie d'ionisation
Première énergie d'ionisation 946,2 kJ / mol
États d'oxydation
-3, +3, +5
Stabilité
L'arsenic élémentaire est stable à l'air sec, mais lorsqu'il est exposé à l'air humide, il se recouvre d'une couche jaune bronze qui peut devenir une couche noire d'oxyde d'arsenic (AsdeuxOU ALORS3).
Décomposition
Lorsque l'arsenic est chauffé jusqu'à la décomposition, il émet de la fumée blanche d'AsdeuxOU ALORS3. La procédure est dangereuse car l'arsine, un gaz très toxique, peut également être libérée.
Auto-allumage
180 ºC
Dureté
3,5 sur l'échelle de dureté de Mohs.
Réactivité
Il n'est pas attaqué par l'acide sulfurique froid ou l'acide chlorhydrique concentré. Réagit avec l'acide nitrique chaud ou l'acide sulfurique, formant de l'acide arsénique et de l'acide arsénique.
Lorsque l'arsenic gris est volatilisé par chauffage et que les vapeurs sont rapidement refroidies, un arsenic jaune se forme. Cela revient à la forme grisâtre, lorsqu'il est soumis à la lumière ultraviolette.
Applications
Alliages
Une petite quantité d'arsenic ajoutée au plomb durcit suffisamment ses alliages pour les utiliser dans le revêtement des câbles et dans la fabrication de batteries de voitures..
L'ajout d'arsenic au laiton, un alliage de cuivre et de zinc, augmente sa résistance à la corrosion. En revanche, il corrige ou réduit la perte de zinc dans le laiton, ce qui entraîne une augmentation de sa durée de vie utile..
électronique
L'arsenic purifié est utilisé dans la technologie des semi-conducteurs où il est utilisé en conjonction avec le gallium et le germanium, ainsi que sous forme d'arséniure de gallium (GaAs) qui est le deuxième semi-conducteur le plus largement utilisé..
Les GaAs ont une bande interdite directe, qui peut être utilisée dans la fabrication de diodes, de lasers et de LED. En plus de l'arséniure de gallium, il existe d'autres arséniures, tels que l'arséniure d'indium et l'arséniure d'aluminium, qui sont également des semi-conducteurs III-V..
Pendant ce temps, l'arséniure de cadmium est un semi-conducteur de type II-IV. Arsine a été utilisé dans le dopage des semi-conducteurs.
Agriculture et conservation du bois
La plupart des applications ont été abandonnées en raison de leur forte toxicité et de celle de leurs composés. La glacedeuxOU ALORS3 a été utilisé comme pesticide, tandis que AsdeuxOU ALORS5 est un ingrédient d'herbicides et d'insecticides.
Acide arsénique (H3AsO4) et des sels tels que l'arséniate de calcium et l'arséniate de plomb ont été utilisés pour stériliser les sols et lutter contre les ravageurs. Cela crée un risque de contamination de l'environnement par l'arsenic..
L'arséniate de plomb a été utilisé comme insecticide sur les arbres fruitiers jusqu'à la première moitié du 20e siècle. Mais en raison de sa toxicité, il a été remplacé par le méthylarsénate de sodium, qui a cessé d'être utilisé pour la même raison depuis 2013.
Médicinal
Jusqu'au 20e siècle, plusieurs de ses composés étaient utilisés comme médicaments. L'arsphénamine et le néolsalvarsan, par exemple, ont été utilisés dans le traitement de la syphilis et de la trypanosomiase.
En 2000, l'utilisation d'AsdeuxOU ALORS3, Composé très toxique, dans le traitement de la leucémie aiguë promyélocytaire résistante à l'acide tout-trans rétinoïque. Récemment, l'isotope radioactif a été utilisé 74Ace pour la localisation de la tumeur.
L'isotope produit de bonnes images, plus claires que celles obtenues avec le 124I, parce que l'iode est transporté vers la thyroïde et produit du bruit dans le signal.
Autres utilisations
L'arsenic était utilisé dans le passé comme additif alimentaire dans la production de volailles et de porcs.
Il est utilisé comme catalyseur dans la fabrication de l'oxyde d'éthylène. Il est également utilisé dans les feux d'artifice et le bronzage. L'oxyde arséneux est utilisé comme décolorant dans la fabrication du verre.
Où est-il situé?
L'arsenic peut être trouvé en petites quantités à l'état élémentaire, avec un haut degré de pureté. Il est présent dans de nombreux composés, tels que: sulfures, arséniures et sulfoarséniides.
On le trouve également dans plusieurs minéraux, notamment: l'arsénopyrite (FeSAs), la loellingite (FeAsdeux), énargite (Cu3Cul4), l'orpiment (commedeuxS3) et realgar (comme4S4).
Comment est-il obtenu?
L'arsénopyrite est chauffée à 650-700 ° C, en l'absence d'air. L'arsenic s'évapore, laissant du sulfure de fer (FeS) comme résidu. Au cours de ce processus, l'arsenic rejoint l'oxygène pour former As4OU ALORS6, connu sous le nom d '«arsenic blanc».
La glace4OU ALORS6 est modifié pour former le AsdeuxOU ALORS3, dont les vapeurs sont collectées et condensées dans un ensemble de chambres en briques, l'arsenic étant purifié par sublimation.
La plupart de l'arsenic est produit par réduction par le carbone de la poussière formée à partir d'AsdeuxOU ALORS3.
Les références
- Stephen R. Marsden. (23 avril 2019). Chimie de l'arsenic. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (3 décembre 2018). Faits intéressants sur l'arsenic. Récupéré de: thinkco.com
- Wikipédia. (2019). Arsenic. Récupéré de: en.wikipedia.org
- Dr Dough Stewart. (2019). Faits sur les éléments de l'arsenic. Chemicool. Récupéré de: chemicool.com
- Société royale de chimie. (2019). Arsenic. Récupéré de: rsc.or
- Les rédacteurs de l'Encyclopaedia Britannica. (03 mai 2019). Arsenic. Encyclopædia Britannica. Récupéré de: britannica.com



Personne n'a encore commenté ce post.