
Caractéristiques, synthèse et utilisations du bromure d'hydrogène (HBr)

le bromure d'hydrogène, un composé chimique de formule HBr, c'est une molécule diatomique à liaison covalente. Le composé est classé comme un halogénure d'hydrogène, étant un gaz incolore qui, lorsqu'il est dissous dans l'eau, forme de l'acide bromhydrique, se saturant à 68,85% p / p à température ambiante..
Les solutions aqueuses à 47,6% p / p forment un mélange azéotropique à point d'ébullition constant bouillant à 124,3 degrés centigrades. Les solutions bouillantes moins concentrées libèrent H2O jusqu'à ce que la composition du mélange azéotropique à point d'ébullition constant soit atteinte..
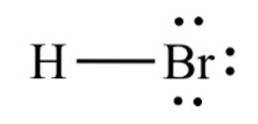
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 3 Manipulation et stockage
- 4 Synthèse
- 5 utilisations
- 6 Références
Proprietes physiques et chimiques
Le bromure d'hydrogène est un gaz incolore à température ambiante avec une odeur aigre et irritante. Le composé est stable, mais s'assombrit progressivement lorsqu'il est exposé à l'air ou à la lumière, comme illustré à la figure 2 (National Center for Biotechnology Information, S.F.).

Il a un poids moléculaire de 80,91 g / mol et une densité de 3,307 g / L, ce qui le rend plus lourd que l'air. Le gaz se condense en produisant un liquide incolore avec un point d'ébullition de -66,73 degrés Celsius.
En continuant à refroidir, le liquide se solidifie en obtenant des cristaux blancs, dont le point de fusion est de -86,82 degrés centigrades avec une densité de 2,603 g / ml (Egon Wiberg, 2001). L'apparence de ces cristaux est illustrée sur la figure 3.

La distance de liaison entre le brome et l'hydrogène est de 1,414 angströms et leur énergie de dissociation est de 362,5 kJ / mol..
Le bromure d'hydrogène est plus soluble dans l'eau que le chlorure d'hydrogène, 221 g peuvent être dissous dans 100 ml d'eau à 0 degré Celsius, ce qui équivaut à un volume de 612 litres de ce gaz pour chaque litre d'eau. Il est également soluble dans l'alcool et d'autres solvants organiques.
En solution aqueuse (acide bromhydrique), les propriétés acides du HBr sont dominantes (comme c'est le cas de HF et HCl) et, dans la liaison entre l'hydrogène et l'halogène, il est plus faible dans le cas du bromure d'hydrogène que dans le chlorure d'hydrogène.
Par conséquent, si le chlore passe à travers le bromure d'hydrogène, la formation de vapeurs brunes caractéristiques du brome moléculaire est observée. La réaction qui l'explique est la suivante:
2HBr + Cl2 → 2HCl + Br2
Cela indique que le bromure d'hydrogène est un agent réducteur plus puissant que le chlorure d'hydrogène et que le chlorure d'hydrogène est un meilleur agent oxydant..
Le bromure d'hydrogène est un acide fort anhydre (sans eau). Réagit rapidement et de manière exothermique avec les bases de toutes sortes (y compris les amines et les amides).
Réagit de manière exothermique avec les carbonates (y compris le calcaire et les matériaux de construction contenant du calcaire) et les hydrogénocarbonates pour générer du dioxyde de carbone.
Réagit avec les sulfures, carbures, borures et phosphures pour générer des gaz toxiques ou inflammables.
Réagit avec de nombreux métaux (y compris l'aluminium, le zinc, le calcium, le magnésium, le fer, l'étain et tous les métaux alcalins) pour générer de l'hydrogène gazeux inflammable.
Répondez violemment avec:
- anhydride acétique
- 2-aminoéthanol
- l'hydroxyde d'ammonium
- phosphure de calcium
- acide chlorosulfonique
- 1,1-difluoroéthylène
- éthylènediamine
- éthylèneimine
- acide sulfurique fumant
- acide perchlorique
- b-propriolactone
- OXID de propylène
- perchlorate d'argent
- Phosphure d'uranium (IV)
- acétate de vinyle
- carbure de calcium
- carbure de rubidium
- acétylure de césium
- acétylure de rubidium
- borure de magnésium
- sulfate de mercure (II)
- phosphure de calcium
- carbure de calcium (Fiche technique chimique, 2016).
Réactivité et dangers
Le bromure d'hydrogène est classé comme un composé corrosif et irritant. Il est extrêmement dangereux en cas de contact avec la peau (irritant et corrosif) et les yeux (irritant) et en cas d'ingestion et d'inhalation (irritant pour les poumons).
Le composé est stocké dans des conteneurs de gaz liquéfié sous pression. Une exposition prolongée au feu ou à une chaleur intense peut entraîner la rupture violente du récipient sous pression, qui peut être libérée en libérant des fumées toxiques irritantes..
Une exposition à long terme à de faibles concentrations ou une exposition à court terme à des concentrations élevées peut entraîner des effets néfastes sur la santé dus à l'inhalation..
La décomposition thermique du bromure d'hydrogène anhydre produit des gaz de brome toxiques. Il peut devenir inflammable s'il réagit en libérant de l'hydrogène. Le contact avec le cyanure produit des gaz toxiques de cyanure d'hydrogène.
L'inhalation provoque une grave irritation du nez et des voies respiratoires supérieures, ce qui peut provoquer des lésions pulmonaires..
L'ingestion provoque des brûlures à la bouche et à l'estomac. Le contact avec les yeux provoque une irritation grave et des brûlures. Le contact avec la peau provoque une irritation et des brûlures.
Si ce produit chimique en solution entre en contact avec les yeux, ils doivent être rincés immédiatement à grande eau, en soulevant occasionnellement les paupières inférieures et supérieures..
Les lentilles de contact ne doivent pas être portées lorsque vous travaillez avec ce produit chimique. Si le tissu oculaire est gelé, consultez immédiatement un médecin..
Si le tissu n'est pas congelé, rincez immédiatement et soigneusement les yeux avec de grandes quantités d'eau pendant au moins 15 minutes, en soulevant de temps en temps les paupières inférieures et supérieures..
Si l'irritation, la douleur, l'enflure ou les déchirures persistent, consultez un médecin dès que possible..
Si ce produit chimique en solution entre en contact avec la peau et ne provoque pas de gelure, rincer immédiatement la peau contaminée avec de l'eau.
Si ce produit chimique entre en contact avec les vêtements, retirer immédiatement les vêtements et laver la peau avec de l'eau.
En cas de gelure, consultez immédiatement un médecin. Vous ne devez pas frotter les zones touchées ni rincer à l'eau. Afin d'éviter d'endommager davantage les tissus, aucune tentative ne doit être faite pour retirer les vêtements gelés des zones givrées..
Si de grandes quantités de ce produit chimique sont inhalées, la personne exposée doit être immédiatement transportée à l'air frais. Si la respiration s'est arrêtée, effectuez une réanimation bouche-à-bouche. La victime doit être maintenue au chaud et au repos, et des soins médicaux doivent être recherchés dès que possible..
Si ce produit chimique en solution a été avalé, consultez immédiatement un médecin.
Manipulation et stockage
Les bouteilles de bromure d'hydrogène doivent être stockées dans un endroit frais et bien ventilé. Sa manipulation doit se faire avec une ventilation adéquate. Il ne doit être conservé que lorsque la température ne dépasse pas 52 degrés Celsius.
Les conteneurs doivent être solidement fixés en position verticale pour éviter qu'ils ne tombent ou ne soient heurtés. De plus, installez le capuchon de protection de la valve, s'il est fourni, fermement en place à la main, et stockez les contenants pleins et vides séparément (praxair inc., 2016).
Lors de la manipulation du produit sous pression, une plomberie et un équipement correctement conçus doivent être utilisés pour résister aux pressions rencontrées. Ne travaillez jamais sur un système sous pression et utilisez un dispositif anti-refoulement dans la canalisation. Les gaz peuvent provoquer une suffocation rapide en raison d'une carence en oxygène.
Stocker et utiliser avec une ventilation adéquate est important. En cas de fuite, fermez la vanne du réservoir et arrêtez le système d'une manière sûre et respectueuse de l'environnement. Réparez ensuite la fuite. Ne placez jamais un récipient où il peut faire partie d'un circuit électrique.
Des gants de sécurité en cuir et des chaussures appropriées doivent être portés lors de la manipulation des bouteilles. Ceux-ci doivent être protégés et pour cela ils doivent être évités, traînés, roulés ou glissés..
Lors du déplacement de la bouteille, le couvercle de valve amovible doit toujours être maintenu en place. N'essayez jamais de soulever une bouteille par son couvercle, qui est uniquement destiné à protéger la soupape..
Lors du déplacement de bouteilles, même sur de courtes distances, utilisez un chariot (chariot, diable, etc.) conçu pour transporter les bouteilles.
Un objet (par exemple une clé, un tournevis, un levier) ne doit jamais être inséré dans les ouvertures du couvercle, car cela pourrait endommager la vanne et provoquer une fuite..
Une clé à sangle réglable est utilisée pour retirer les capuchons trop serrés ou rouillés. La vanne doit s'ouvrir lentement et si cela est impossible, arrêtez de l'utiliser et contactez votre fournisseur. Bien entendu, la valve du contenant doit être fermée après chaque utilisation..
Ledit conteneur doit être maintenu fermé même lorsqu'il est vide. La flamme ou la chaleur localisée ne doivent jamais être appliquées directement sur une partie quelconque du récipient. Des températures élevées peuvent endommager le contenant et provoquer une défaillance prématurée du dispositif de décompression, en évacuant le contenu du contenant (praxair inc., 2016).
La synthèse
Le bromure d'hydrogène gazeux peut être fabriqué en laboratoire par bromation de tétraline (1,2,3,4-tétrahydronaphtalène). L'inconvénient est que la moitié du brome est perdue. Le rendement est d'environ 94%, ou ce qui est le même, 47% du brome finit sous forme de HBr.
CdixH12 + 4 ch.deux → CdixH8Br4 + 4 HBr
Le bromure d'hydrogène gazeux peut également être synthétisé en laboratoire en faisant réagir de l'acide sulfurique concentré avec du bromure de sodium..
NaBr (s) + HdeuxSW4 → HBr (g) + NaHSO4
L'inconvénient de ce procédé est qu'une grande partie du produit est perdue par oxydation avec un excès d'acide sulfurique pour former du brome et du dioxyde de soufre..
2 HBr + HdeuxSW4 → Brdeux + SWdeux + 2 heuresdeuxOU ALORS
Le bromure d'hydrogène peut être préparé en laboratoire par réaction entre l'hydrogène gazeux purifié et le brome. Ceci est catalysé par l'amiante platine et est réalisé dans un tube de quartz à 250 ° C.
Brdeux + Hdeux[Pt] → 2 HBr
Le bromure d'hydrogène anhydre peut également être produit à petite échelle par thermolyse du bromure de triphénylphosphonium dans le xylène au reflux..
HBr peut être obtenu par la méthode du phosphore rouge. Tout d'abord, le phosphore rouge est ajouté dans le réacteur à eau et plus tard, lentement, le brome sous agitation et la réaction de l'acide bromhydrique et de l'acide phosphoreux, par sédimentation, filtration et la distillation obtenue sera l'acide bromhydrique..
P4+6 Brdeux+12 heuresdeuxO → 12 HBr + 4 H3PO3
Le bromure d'hydrogène préparé par les méthodes ci-dessus peut être contaminé par Brdeux, qui peut être éliminé en faisant passer le gaz à travers une solution de phénol dans le tétrachlorométhane ou un autre solvant approprié à température ambiante, produisant du 2, 4, 6-tribromophénol et générant ainsi plus de HBr.
Ce processus peut également être réalisé à travers des copeaux de cuivre à haute température ou de la gaze de cuivre (Hydrogène: bromure d'hydrogène, 1993-2016).
Applications
HBr est utilisé dans la fabrication de bromures organiques, tels que le bromure de méthyle, le bromoéthane, etc., et les bromures inorganiques, tels que le bromure de sodium, le bromure de potassium, le bromure de lithium et le bromure de calcium, etc..
Il est également utilisé dans des applications photographiques et pharmaceutiques ou pour la synthèse de sédatifs et d'anesthésiques. De plus, il est appliqué dans le séchage industriel, la finition textile, les agents de revêtement, le traitement de surface et les agents ignifuges..
Le composé est également utilisé pour graver des feuilles de silicium polycristallin, pour la fabrication de puces informatiques (Interscan Corporation, 2017).
Le bromure d'hydrogène est un bon solvant pour certains minerais métalliques, utilisé dans le raffinage de métaux de haute pureté.
Dans l'industrie pétrolière, il est utilisé comme séparation de composés alcoxy et phénoxy, et comme catalyseur pour l'oxydation d'hydrocarbures cycliques et d'hydrocarbures en chaîne en cétones, en acide ou en peroxyde. Il est également utilisé dans les colorants synthétiques et les épices..
Un gaz HBr de haute qualité est utilisé pour la gravure et le nettoyage des matières premières semi-conductrices (SHOWA DENKO K.K, n.d.).
Le composé est utilisé comme réactif analytique dans la détermination du soufre, du sélénium, du bismuth, du zinc et du fer, pour la séparation de l'étain de l'arsenic et de l'antimoine. C'est un catalyseur d'alkylation et un agent réducteur utilisé en synthèse organique.
Le bromure d'hydrogène peut être utilisé pour la production d'acide bromhydrique. L'acide bromhydrique est un acide minéral très fort, plus fort que l'acide chlorhydrique.
Le HBr est très réactif et corrosif pour la plupart des métaux. L'acide est un réactif courant en chimie organique, utilisé pour l'oxydation et la catalyse. Il est également efficace dans l'extraction de certains minéraux métalliques (Bromure d'hydrogène, 2016).
Les références
- Interscan Corporation. (2017). Instrumentation de surveillance du bromure d'hydrogène et du bromure d'hydrogène. Récupéré de gasdetection.com.
- Fiche technique chimique. (2016). Récupéré de BROMURE D'HYDROGÈNE, ANHYDRE: cameochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Chimie inorganique. Presse académique.
- Bromure d'hydrogène. (2016). Récupéré de ChemicalBook.
- Hydrogène: bromure d'hydrogène. (1993-2016). Récupéré de WebElements.
- Fiche signalétique Bromure d'hydrogène. (2005, 9 octobre). Récupéré de sciencelab.com.
- Centre national d'information sur la biotechnologie. (S.F.). Base de données des composés PubChem; CID = 260. Récupéré de pubchem.ncbi.nlm.nih.gov.
- praxair inc. (2016, 17 octobre). Bromure d'hydrogène anhydre Fiche de données de sécurité P-4605. Récupéré de praxair.com.
- SHOWA DENKO K.K. (s.f.). bromure d'hydrogène. Récupéré de www.sdk.co.jp.



Personne n'a encore commenté ce post.