
Structure du bromure de lithium, propriétés, utilisations, risques
le bromure de lithium c'est un sel neutre d'un métal alcalin dont la formule chimique est LiBr. La formule exprime que son solide cristallin est composé d'ions Li+ et Br- dans un rapport 1: 1. Ses cristaux sont blancs ou beige clair. Il est très soluble dans l'eau et c'est aussi un sel assez hygroscopique..
Cette dernière propriété permet son utilisation comme déshydratant dans les systèmes de climatisation et de réfrigération. De même, le bromure de lithium a été utilisé depuis le début du XXe siècle dans le traitement de certains troubles de santé mentale, son utilisation étant abandonnée en raison d'une utilisation inappropriée du sel..
LiBr est produit en traitant le carbonate de lithium, LideuxCO3, avec de l'acide bromhydrique. Après chauffage du milieu, il précipite hors de la solution aqueuse sous forme d'hydrate..
Ce sel irrite la peau et les yeux au contact, alors qu'il provoque une irritation des voies respiratoires par inhalation. L'ingestion de sels de lithium peut provoquer des nausées, des vomissements, de la diarrhée et des étourdissements.
Index des articles
- 1 Structure du bromure de lithium
- 1.1 Hydrate et lunettes
- 2 propriétés
- 2.1 Poids moléculaire
- 2.2 Apparence
- 2.3 Odeur
- 2.4 Point de fusion
- 2.5 Point d'ébullition
- 2.6 Solubilité dans l'eau
- 2.7 Solubilité dans les solvants organiques
- 2.8 Indice de réfraction (ηD)
- 2.9 Capacité thermique
- 2.10 Entropie molaire standard (Sθ 298)
- 2.11 Point d'éclair
- 2.12 Stabilité
- 2.13 Décomposition
- 2,14 pH
- 2.15 Réactivité
- 2.16 Production
- 3 Nomenclature
- 4 utilisations
- 4.1 Déshydratant
- 4.2 Fibres
- 4.3 Produits pharmaceutiques
- 4.4 Sédatif
- 5 risques
- 5.1 Toxicité de contact
- 5.2 Ingestion
- 6 Références
Structure du bromure de lithium
La formule LiBr précise que le rapport Li / Br est égal à 1; pour chaque Li cation+ il doit y avoir un anion Br- homologue. Par conséquent, ce rapport doit être maintenu constant dans tous les coins du cristal LiBr..
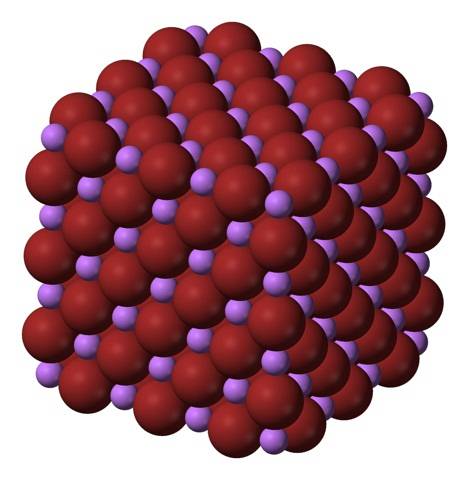
Ions Li+ et Br- ils s'attirent, diminuant les répulsions entre charges égales, pour former ainsi un cristal cubique comme le sel gemme; c'est isomorphe à NaCl (image du haut). Notez que par lui-même l'ensemble a une géométrie cubique.
Dans ce cristal, le Li+ ils sont plus petits et ont une couleur violet clair; tandis que le Br- ils sont plus volumineux et de couleur brun foncé. On observe que chaque ion a six voisins, ce qui revient à dire qu'ils présentent une coordination octaédrique: LiBr6 ou Li6Br; cependant, si la maille élémentaire est considérée, le rapport Li / Br reste 1.
Il s'agit de la structure cristalline adoptée de préférence par LiBr. Cependant, elle peut également former d'autres types de cristaux: la wurzite, si elle cristallise à basse température (-50 ° C) sur un substrat; ou cubique centré sur le corps, ou de type CsCl, si le cristal de sel gemme cubique est soumis à une pression élevée.
Hydrate et lunettes
Ce qui précède est applicable pour LiBr anhydre. Ce sel est hygroscopique et peut donc absorber l'humidité de l'environnement, insérant des molécules d'eau dans ses propres cristaux. Ainsi, les hydrates LiBrnH surgissentdeuxO (n = 1, 2, 3…, 10). Pour chaque hydrate, la structure cristalline est différente.
Par exemple, des études cristallographiques ont déterminé que LiBrHdeuxOu adoptez une structure de type pérovskite.
Lorsque ces hydrates sont en solution aqueuse, ils peuvent surfusion et vitrification; c'est-à-dire qu'ils adoptent une structure apparemment cristalline mais désordonnée moléculaire. Dans de telles conditions, les liaisons hydrogène dans l'eau deviennent assez importantes..
Propriétés
Poids moléculaire
88,845 g / mol.
Apparence
Solide cristallin blanc ou beige clair.
Odeur
Toilette.
Point de fusion
552 ºC (1 026 ºF, 825 K).
Point d'ébullition
1 256 ºC (2 309 ºF, 1 538 K).
Solubilité dans l'eau
166,7 g / 100 mL à 20 ° C Notez sa haute solubilité.
Solubilité dans les solvants organiques
Soluble dans le méthanol, l'éthanol, l'éther et l'acétone. Légèrement soluble dans la pyridine, un composé aromatique et moins polaire que les précédents.
Indice de réfraction (ηD)
1 784.
Capacité calorique
51,88 J / mol K.
Entropie molaire standard (Sθ 298)
66,9 J / mol K.
point d'allumage
1 265 ° C Il est considéré comme ininflammable.
Stabilité
Stable. La forme anhydre, cependant, est extrêmement hygroscopique.
Décomposition
Décomposé par chauffage, il produit de l'oxyde de lithium.
pH
Entre pH 6 et 7 en solution aqueuse (100 g / L, 20 ºC).
Réactivité
Le bromure de lithium n'est pas réactif dans des conditions environnementales normales. Cependant, vous pouvez ressentir de fortes réactions avec les acides forts lorsque la température augmente..
Lors de la dissolution dans l'eau, il y a une augmentation de la température, causée par une enthalpie d'hydratation négative.
Production
Le LiBr est produit en faisant réagir de l'hydroxyde de lithium ou du carbonate de lithium avec de l'acide bromhydrique dans une réaction de neutralisation:
LideuxCO3 + HBr => LiBr + COdeux + HdeuxOU ALORS
Le bromure de lithium est obtenu sous forme d'hydrate. Pour obtenir la forme anhydre, il est nécessaire de chauffer le sel hydraté sous vide..
Nomenclature
Le nom «bromure de lithium» vient du fait qu'il s'agit d'un halogénure métallique, ainsi nommé selon la nomenclature du stock. D'autres noms, également valables mais moins utilisés, sont le monobromure de lithium, selon la nomenclature systématique; et le bromure lithique (la valence unique de +1 pour le lithium), selon la nomenclature traditionnelle.
Applications
Déshydratant
Le LiBr est un sel hygroscopique, formant une saumure concentrée capable d'absorber l'humidité de l'air sur une large gamme de températures. Cette saumure est utilisée comme déshydratant dans les systèmes de climatisation et de réfrigération..
Les fibres
Il est utilisé pour augmenter le volume de la laine, des cheveux et d'autres fibres organiques.
Adduits pharmaceutiques
LiBr forme des adduits avec certains composés pharmaceutiques, en modulant leur action. Un adduit est la combinaison par coordination de deux molécules ou plus, sans produire une altération structurelle de l'une des molécules jointes.
Sédatif
Le bromure de lithium a été utilisé pour la première fois comme sédatif dans certains troubles mentaux, et il a été arrêté en 1940. Actuellement, le carbonate de lithium est utilisé; mais dans tous les cas, le lithium est l'élément qui exerce l'action thérapeutique dans les deux composés.
Le lithium est utilisé dans le traitement du trouble bipolaire, ayant été utile dans le contrôle des épisodes maniaques du trouble. On pense que le lithium inhibe l'activité des neurotransmetteurs excitateurs, tels que la dopamine et l'acide glutamique.
D'autre part, il augmente l'activité du système inhibiteur médié par le neurotransmetteur acide gamma-amino-butyrique (GABA). Ces actions pourraient faire partie de la base de l'action thérapeutique du lithium.
Des risques
Toxicité de contact
Irritation et sensibilisation cutanées, allergies. Lésions oculaires graves ou irritation des yeux, des voies respiratoires, des voies nasales et de la gorge.
Ingestion
Les principaux symptômes dus à l'ingestion de bromure de lithium sont: troubles gastro-intestinaux, vomissements et nausées. Les autres effets indésirables de l'ingestion de sel comprennent l'agitation, les spasmes et la perte de conscience..
La condition connue sous le nom de «bromisme» peut survenir avec des doses de bromure de lithium supérieures à 225 mg / jour..
Certains des signes et symptômes suivants peuvent apparaître dans les blagues: exacerbation de l'acné et perte d'appétit, tremblements, problèmes d'élocution, apathie, faiblesse et agitation maniaque.
Les références
- Formulation chimique. (2019). Bromure de lithium. Récupéré de: formulacionquimica.com
- David C. Johnson. (10 juillet 2008). Nouvelle commande pour le bromure de lithium. Nature. doi.org/10.1038/454174a
- Aayushi Jain et R.C. Dixit. (s.f.). Transition de phase structurelle dans le bromure de lithium: effet de la pression et de la température. [PDF]. Récupéré de: ncpcm.in
- Takamuku et coll. (1997). Études de diffraction des rayons X sur des solutions aqueuses de bromure de lithium et d'iodure de lithium surfondues. Département de chimie, Faculté des sciences, Université de Fukuoka, Nanakuma, Jonan-ku, Fukuoka 814-80, Japon.
- Centre national d'information sur la biotechnologie. (2019). Bromure de lithium. Base de données PubChem, CID = 82050. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2019). Bromure de lithium. Récupéré de: en.wikipedia.org
- Société royale de chimie. (2019). Bromure de lithium. Chemspider. Récupéré de: chemspider.com



Personne n'a encore commenté ce post.