
Effets de substitution nucléophile aromatique, exemples
La substitution nucléophile aromatique (SNAr) est une réaction qui se produit en chimie organique, qui consiste en le déplacement d'un bon groupe partant par un nucléophile entrant. Du point de vue de son mécanisme et de ses aspects électroniques, c'est le côté opposé de la substitution aromatique électrophile (SEAr).
Généralement, le groupe partant est un halogène, qui se présente sous la forme d'un anion halogénure X-. Cette réaction ne peut avoir lieu que si le cycle aromatique (principalement le benzène) est déficient en électrons; c'est-à-dire s'il a des groupes substituants attracteurs d'électrons.

L'image du haut décrit ce qui a été dit dans le paragraphe précédent. Le groupe d'attracteurs d'électrons EWG (pour son acronyme en anglais: Groupe de retrait d'électrons), active le cycle aromatique pour l'attaque nucléophile de l'espèce négative Nu-. On voit qu'il se forme un intermédiaire (au centre), à partir duquel l'halogénure X est libéré ou sort-.
Notez qu'en termes simples, X remplace Nu dans un cycle aromatique. Cette réaction est très polyvalente et nécessaire dans la synthèse de nouveaux médicaments, ainsi que dans les études de chimie organique synthétique..
Index des articles
- 1 Aspects généraux
- 1.1 Différences avec la substitution aromatique électrophile
- 2 effets
- 2.1 Du nombre de substituants
- 2.2 Du groupe partant
- 3 Exemple
- 3.1 Commentaire final
- 4 Références
Aspects généraux
Le cycle aromatique peut être «chargé» ou «déchargé» d'électrons selon ce que sont ses substituants (ceux qui remplacent la liaison C-H d'origine).
Lorsque ces substituants peuvent donner une densité électronique au cycle, on dit qu'ils l'enrichissent d'électrons; Si, au contraire, ce sont des attracteurs de densité électronique (l'EWG mentionné ci-dessus), alors on dit qu'ils appauvrissent l'anneau d'électrons.
Dans les deux cas, le cycle est activé pour une réaction aromatique spécifique, tandis qu'il est désactivé pour l'autre..
Par exemple, on dit qu'un cycle aromatique riche en électrons est actif pour la substitution aromatique électrophile; c'est-à-dire qu'il peut donner ses électrons à une espèce électrophile, E+. Cependant, il ne donnera pas d'électrons à une espèce Nu-, puisque les charges négatives se repousseraient.
Or, si l'anneau est pauvre en électrons, il n'a aucun moyen de les donner à l'espèce E+ (SEAr ne se produit pas); d'autre part, il a la disponibilité d'accepter les électrons de l'espèce Nu- (le SNAr est développé).
Différences avec la substitution électrophile aromatique
Une fois que les aspects généraux des intrants ont été clarifiés, certaines différences entre le SNAr et le SEAr peuvent maintenant être répertoriées:
- Le cycle aromatique agit comme un électrophile (déficient en électrons) et est attaqué par un nucléophile.
- Un groupe partant X est substitué sur le cycle; pas un H+
- Des carbocations ne se forment pas, mais des intermédiaires avec une charge négative qui peut être délocalisée par résonance
- La présence de plus de groupes attracteurs dans l'anneau accélère la substitution au lieu de la ralentir
- Enfin, ces groupes n'ont aucun effet direct sur l'endroit (sur quel carbone) la substitution se produira. La substitution se produira toujours sur le carbone attaché au groupe partant X.
Le dernier point est également illustré dans l'image: la liaison C-X se rompt pour former la nouvelle liaison C-Nu.
Modifier les effets
Du nombre de substituants
Naturellement, plus l'anneau est pauvre en électrons, plus l'ARNr est rapide et moins les conditions nécessaires à son apparition sont drastiques. Considérez l'exemple suivant représenté dans l'image ci-dessous:
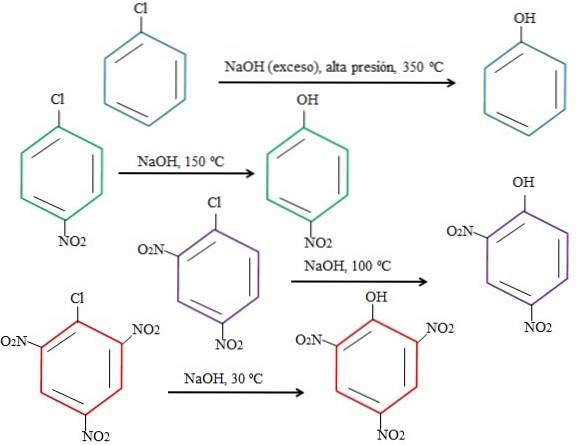
Notez que le 4-nitrochlorobenzène (anneau bleu) nécessite des conditions drastiques (haute pression et température de 350 ºC) pour que la substitution de Cl par OH se produise. Dans ce cas, le chlore est le groupe partant (Cl-) et hydroxyde le nucléophile (OH-).
Lorsque le groupe NON apparaîtdeux, qui est un attracteur d'électrons (anneau vert), la substitution peut être effectuée à une température de 150 ° C à pression ambiante. Au fur et à mesure que le nombre de groupes NO augmentedeux présent (anneaux violets et rouges), la substitution a lieu à des températures plus basses et plus basses (100 ° C et 30 ° C, respectivement).
Par conséquent, les groupes ne sont PASdeux accélère l'ARNr et prive l'anneau d'électrons, ce qui le rend plus sensible aux attaques OH-.
Les positions relatives de Cl par rapport à NO ne seront pas expliquées ici.deux dans le 4-nitrochlorobenzène, et comment ceux-ci modifient la vitesse de la réaction; Par exemple, les vitesses de réaction du 2-nitrochlorobenzène et du 3-nitrochlorobenzène sont différentes, ce dernier étant le plus lent par rapport aux autres isomères.
Du groupe sortant
Reprenant le 4-nitrochlorobenzène, sa réaction de substitution est plus lente par rapport à son homologue fluoré:
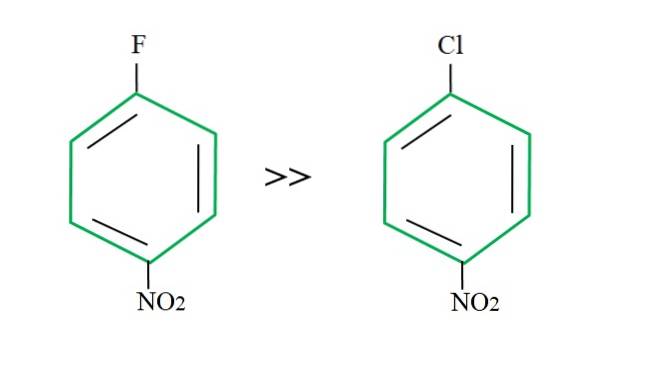
L'explication de cela ne peut résider dans aucune autre variable que la différence entre F et Cl. Le fluor est un terrible groupe partant, car la liaison C-F est plus difficile à rompre que la liaison C-Cl. Par conséquent, la rupture de cette liaison n'est pas l'étape déterminante de la vitesse pour le SNAr, mais l'ajout du Nu- à l'anneau aromatique.
Parce que le fluor est plus électronégatif que le chlore, l'atome de carbone qui lui est lié présente une plus grande déficience électronique (Cδ+-Fδ-). Par conséquent, le carbone de la liaison C-F est beaucoup plus susceptible d'être attaqué par Nu- que celle de la liaison C-Cl. C'est pourquoi la substitution de F pour OH est beaucoup plus rapide que celle de Cl pour OH.
Exemple
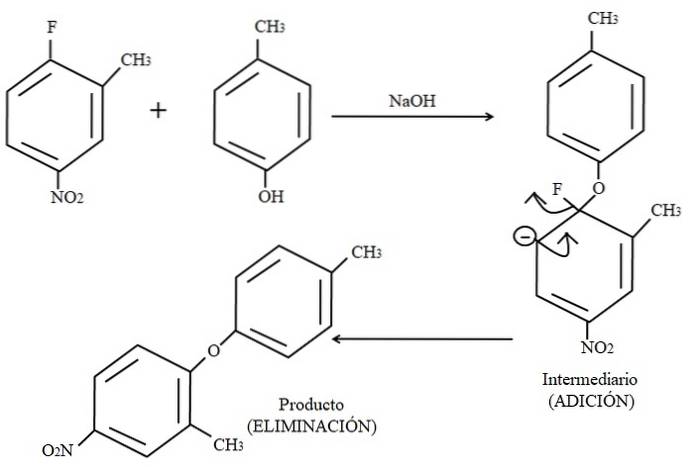
Enfin, un exemple de ce type de réactions organiques est présenté ci-dessous dans l'image ci-dessus. Le para-crésol ne semble pas être un nucléophile; mais comme il y a un milieu basique, son groupe OH est déprotoné, le laissant comme un anion phénoxyde, qui attaque le 2-méthyl-4-nitrofluorobenzène.
Lorsque cette attaque se produit, on dit que le nucléophile s'ajoute à l'électrophile (le cycle aromatique du 2-méthyl-4-nitrofluorobenzène). Cette étape est visible à droite de l'image, où le composé intermédiaire est formé avec les deux substituants appartenant au cycle.
Lorsque le para-crésol est ajouté, une charge négative apparaît qui est délocalisée par résonance dans l'anneau (notez qu'elle cesse d'être aromatique).
Seule la dernière structure de résonance est montrée dans l'image, à partir de laquelle le fluor se termine par F-; mais en réalité, ladite charge négative se délocalise même dans les atomes d'oxygène du groupe NOdeux. Après l'étape d'addition vient l'étape d'élimination, la dernière, c'est-à-dire lorsque le produit est finalement formé.
Commentaire final
Le groupe NONdeux le reste peut être réduit au groupe NHdeux, et à partir de là, il est possible d'effectuer plus de réactions de synthèse pour modifier la molécule finale. Cela met en évidence le potentiel de synthèse de l'ARNr, et que son mécanisme se compose également de deux étapes: l'une pour l'addition et l'autre pour l'élimination..
Actuellement, cependant, il existe des preuves expérimentales et informatiques que la réaction se déroule en fait selon un mécanisme concerté, où les deux étapes se produisent simultanément à travers un complexe activé et non un intermédiaire..
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley plus.
- Wikipédia. (2019). Substitution aromatique nucléophile. Récupéré de: en.wikipedia.org
- James Ashenhurst. (06 septembre 2019). Substitution Aromatique Nucléophile (NAS). Récupéré de: masterorganicchemistry.com
- Chimie LibreTexts. (05 juin 2019). Substitution Aromatique Nucléophile. Récupéré de: chem.libretexts.org



Personne n'a encore commenté ce post.