
Structure, propriétés et utilisations du bromure d'argent (AgBr)
le bromure d'argent c'est un sel inorganique dont la formule chimique est AgBr. Son solide est constitué de cations Ag+ et Br anions- dans un rapport 1: 1, attirés par des forces électrostatiques ou des liaisons ioniques. On peut voir comme si l'argent métallique avait donné l'un de ses électrons de valence au brome moléculaire.
Sa nature ressemble à ses «frères et sœurs» de chlorure et d'iodure d'argent. Les trois sels sont insolubles dans l'eau, ont des couleurs similaires et sont également sensibles à la lumière; c'est-à-dire qu'ils subissent des réactions photochimiques. Cette propriété a été utilisée pour obtenir des photographies, en raison de la réduction des ions Ag+ à l'argent métallique.
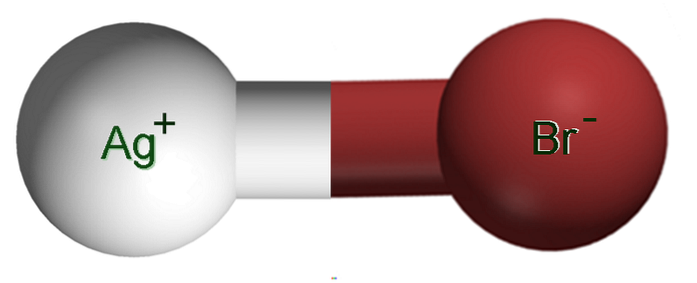
L'image ci-dessus montre une paire d'ions Ag+Br-, dans lequel les sphères blanches et brunes correspondent aux ions Ag+ et Br-, respectivement. Ici, ils représentent la liaison ionique comme Ag-Br, mais il est nécessaire d'indiquer qu'il n'y a pas de telle liaison covalente entre les deux ions.
Il peut sembler contradictoire que l'argent soit celui qui apporte la couleur noire aux photographies sans couleur. C'est parce que l'AgBr réagit avec la lumière, générant une image latente; qui, ensuite, est intensifiée en augmentant la réduction de l'argent.
Index des articles
- 1 Structure du bromure d'argent
- 1.1 Défauts cristallins
- 2 Synthèse
- 3 propriétés
- 3.1 Apparence
- 3.2 Masse moléculaire
- 3.3 Densité
- 3.4 Point de fusion
- 3.5 Point d'ébullition
- 3.6 Solubilité dans l'eau
- 3.7 Indice de réfraction
- 3.8 Capacité calorifique
- 3.9 Sensibilité à la lumière
- 4 utilisations
- 5 Références
Structure du bromure d'argent
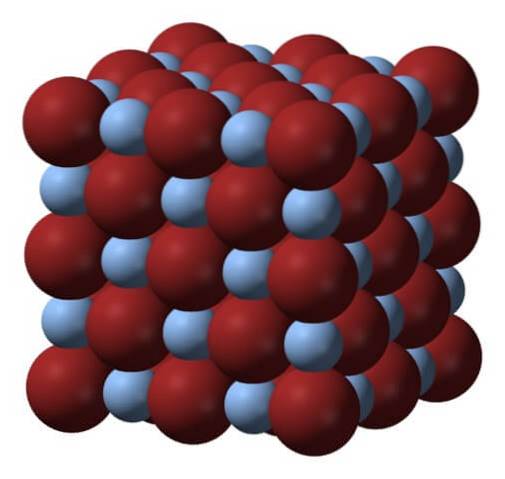
Ci-dessus se trouve le réseau ou la structure cristalline du bromure d'argent. Voici une représentation plus fidèle de la différence de taille entre les rayons ioniques d'Ag+ et Br-. Br anions-, plus volumineux, ils laissent des interstices où se trouvent les cations Ag+, qui est entouré de six Br- (et vice versa).
Cette structure est caractéristique d'un système cristallin cubique, spécifiquement de type sel gemme; le même, par exemple, que pour le chlorure de sodium, NaCl. En fait, l'image facilite cela en arrangeant une frontière cubique parfaite.
À première vue, on constate qu'il existe une certaine différence de taille entre les ions. Ceci, et peut-être les caractéristiques électroniques de l'Ag+ (et l'effet possible de certaines impuretés), conduit à des cristaux d'AgBr présentant des défauts; c'est-à-dire les endroits où la séquence de classement des ions dans l'espace est "cassée".
Défauts cristallins
Ces défauts consistent en des vides laissés par des ions absents ou déplacés. Par exemple, entre six anions Br- normalement, le cation Ag doit être+; mais à la place, il peut y avoir un vide dû au fait que l'argent s'est déplacé dans un autre espace (défaut de Frenkel).
Bien qu'ils affectent le réseau cristallin, ils favorisent les réactions de l'argent avec la lumière; et plus les cristaux ou leur amas (taille des grains) sont gros, plus le nombre de défauts est grand, et par conséquent, il sera plus sensible à la lumière. De même, les impuretés influencent la structure et cette propriété, en particulier celles qui peuvent être réduites avec des électrons..
En conséquence, les gros cristaux d'AgBr nécessitent moins d'exposition à la lumière pour les réduire; c'est-à-dire qu'ils sont plus souhaitables à des fins photographiques.
La synthèse
En laboratoire, le bromure d'argent peut être synthétisé en mélangeant une solution aqueuse de nitrate d'argent, AgNO3, avec le sel de bromure de sodium, NaBr. Le premier sel apporte l'argent et le second le bromure. Ce qui suit est une réaction de double déplacement ou métathèse qui peut être représentée par l'équation chimique ci-dessous:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Notez que le sel de nitrate de sodium, NaNO3, il est soluble dans l'eau, tandis que l'AgBr précipite sous forme de solide de couleur jaune pâle. Ensuite, le solide est lavé et soumis à un séchage sous vide. En plus du NaBr, le KBr pourrait également être utilisé comme source d'anions bromure.
D'autre part, l'AgBr peut être naturellement obtenu grâce à sa bromirite minérale et à ses processus de purification appropriés..
Propriétés
Apparence
Solide semblable à de l'argile, jaune blanchâtre.
Masse moléculaire
187,77 g / mol.
Densité
6,473 g / mL.
Point de fusion
432 ° C.
Point d'ébullition
1502 ° C.
Solubilité dans l'eau
0,140 g / mL à 20 ° C.
Indice de réfraction
2 253.
Capacité thermique
270 J / Kg K.
Sensibilité à la lumière
Il a été dit dans la section précédente qu'il existe des défauts dans les cristaux d'AgBr qui favorisent la sensibilité de ce sel à la lumière, car ils piègent les électrons formés; et ainsi, en théorie, ils sont empêchés de réagir avec d'autres espèces dans l'environnement, comme l'oxygène dans l'air.
L'électron est libéré de la réaction Br- avec un photon:
Br- + hv => 1 / 2Brdeux + et-
Notez que Br est produitdeux, qui tachera le rouge solide s'il n'est pas enlevé. Les électrons libérés réduisent les cations Ag+, dans ses interstices, à l'argent métallique (parfois représenté comme Ag0):
Ag+ + et- => Ag
Ayant alors l'équation nette:
AgBr => Ag + 1 / 2Brdeux
Lorsque les "premières couches" d'argent métallique se forment en surface, on dit qu'il y a une image latente, toujours invisible à l'œil humain. Cette image devient des millions de fois plus visible si une autre espèce chimique (comme l'hydroquinone et la phénidone, dans le processus de développement) augmente la réduction des cristaux d'AgBr en argent métallique.
Applications

Le bromure d'argent est le plus largement utilisé de tous ses halogénures dans le domaine du développement de films photographiques. AgBr est appliqué sur lesdits films, réalisés avec de l'acétate de cellulose, mis en suspension dans de la gélatine (émulsion photographique), et en présence de 4- (méthylamino) phénol sulfate (Metol) ou phénidone, et d'hydroquinone..
Avec tous ces réactifs, l'image latente peut prendre vie; terminer et accélérer la transformation de l'argent ionique en argent métallique. Mais, si vous ne procédez pas avec un certain soin et une certaine expérience, tout l'argent sur la surface s'oxydera et le contraste entre les couleurs noir et blanc prendra fin..
C'est pourquoi les étapes d'arrêt, de fixation et d'immersion de lavage des films photographiques sont vitales..
Il y a des artistes qui jouent avec ces processus de telle manière qu'ils créent des nuances de gris, qui enrichissent la beauté de l'image et leur propre héritage; et ils font tout cela, parfois peut-être sans s'en douter, grâce à des réactions chimiques, dont la base théorique peut devenir un peu complexe, et à un AgBr sensible à la lumière qui marque un point de départ.
Les références
- Wikipédia. (2019). Bromure d'argent. Récupéré de: en.wikipedia.org
- Michael W. Davidson. (2015, 13 novembre). Galerie d'images numériques à lumière polarisée: Bromure d'argent. Olympe. Récupéré de: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Bromure d'argent (AgBr). Récupéré de: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann et Claudia Schneeweiss. (29 juin 2004). Émulsions artisanales à base de bromure d'argent pour les utilisateurs en holographie: fabrication, traitement et application, Proc. SPIE 5290, Holographie Pratique XVIII: Matériaux et Applications; doi: 10,1117 / 12,525035; https://doi.org/10.1117/12.525035
- Alan G. Shape. (1993). Chimie inorganique. (Deuxième édition.). Éditorial Reverté.
- Carlos Güido et Ma Eugenia Bautista. (2018). Introduction à la chimie photographique. Récupéré de: fotografia.ceduc.com.mx
- García D. Bello. (9 janvier 2014). Chimie, photographie et Chema Madoz. Récupéré de: diméthylsulfuro.es



Personne n'a encore commenté ce post.