
Structure butanale, propriétés, utilisations et risques
le butanal c'est un aldéhyde à chaîne ouverte, composé de quatre atomes de carbone, et analogue au butane; c'est en fait la deuxième forme la plus oxydée du butane hydrocarboné après l'acide butyrique. Sa formule moléculaire est CH3CHdeuxCHdeuxCHO, où -CHO est le groupe formyle.
Cet aldéhyde, l'un des plus légers, est constitué d'un liquide transparent et inflammable moins dense que l'eau. De plus, il est soluble dans l'eau et miscible avec la plupart des solvants organiques; il peut donc être utilisé pour avoir des mélanges organiques monophasés.
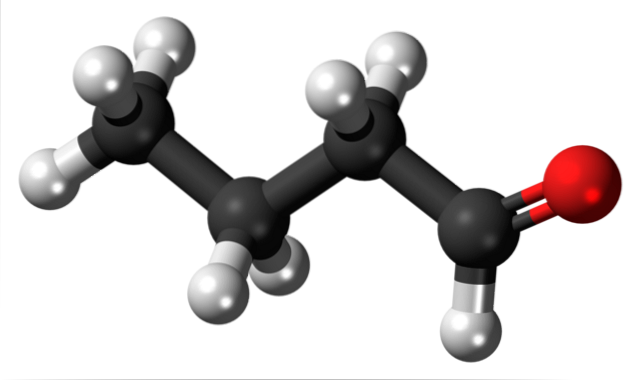
La présence du groupement carbonyle (celui de la sphère rouge, image du haut) donne une polarité chimique à la molécule de butanal, et donc la capacité de vivre l'interaction dipôle-dipôle entre ses molécules; bien qu'aucune liaison hydrogène ne se forme entre eux.
Il en résulte que le butanal a des points d'ébullition et de fusion plus élevés que le butane, mais inférieurs à ceux présentés par l'alcool n-butylique..
Le butanal est utilisé comme solvant et est un intermédiaire pour obtenir de nombreux produits; tels que les accélérateurs de vulcanisation pour caoutchoucs, résines, produits pharmaceutiques et agrochimiques.
Le butanal est un composé toxique qui, par inhalation, peut provoquer une inflammation des voies respiratoires supérieures, des bronches et un œdème pulmonaire pouvant même avoir des conséquences fatales.
Index des articles
- 1 Structure du butanal
- 1.1 Conformités
- 2 propriétés
- 2.1 Noms chimiques
- 2.2 Formule moléculaire
- 2.3 Apparence physique
- 2.4 Odeur
- 2.5 Point d'ébullition
- 2.6 Point de fusion
- 2.7 Point d'éclair
- 2.8 Solubilité dans l'eau
- 2.9 Solubilité dans les solvants organiques
- 2.10 Densité
- 2.11 Densité de vapeur
- 2.12 Pression de vapeur
- 2.13 Auto-allumage
- 2.14 Viscosité
- 2.15 Chaleur de combustion
- 2.16 Chaleur de vaporisation
- 2.17 Tension superficielle
- 2.18 Seuil olfactif
- 2.19 Indice de réfraction
- 2.20 Moment dipolaire
- 2.21 Longueurs d'onde (λ) d'absorption maximale dans l'eau
- 2.22 Polymérisation
- 2.23 Réactivité
- 2.24 Condensation aldolique
- 3 Synthèse
- 4 utilisations
- 4.1 Industriel
- 4.2 Autres
- 5 risques
- 6 Références
Structure butanale
On vient de mentionner que le groupe formyle, -CHO, confère une polarité à la molécule de butanal ou de butyraldéhyde en raison de l'électronégativité plus élevée de l'atome d'oxygène. En conséquence, ses molécules peuvent interagir les unes avec les autres par le biais de forces dipôle-dipôle..
Dans l'image du haut, il est montré, avec un modèle de sphères et de barres, que la molécule de butanal a une structure linéaire. Le carbone du groupe -CHO a une hybridation spdeux, tandis que les carbones restants sp hybridation3.
Non seulement cela, mais il est également flexible, et ses liens peuvent pivoter sur leurs propres axes; et ainsi, différentes conformations ou conformères sont générées (même composé, mais avec leurs liens tournés).
Conformateurs
L'image suivante explique mieux ce point:
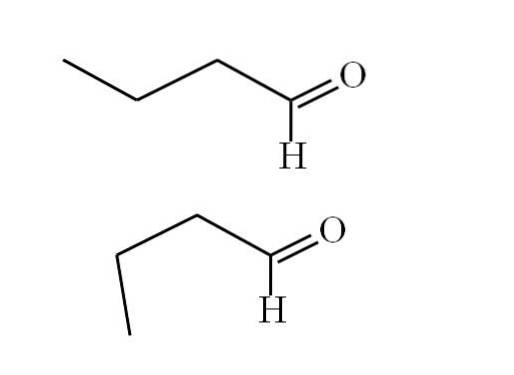
Le premier conformère (celui du haut) correspond à la molécule de la première image: le groupe méthyle à gauche, -CH3, et le groupe -CHO, sont dans des positions anti-parallèles entre eux; l'un pointe vers le haut et l'autre vers le bas, respectivement.
Pendant ce temps, le deuxième conformère (le plus bas) correspond à la molécule avec -CH3 et le -CHO dans des positions éclipsées; c'est-à-dire qu'ils pointent tous les deux dans la même direction.
Les deux conformères sont rapidement interchangeables et, par conséquent, la molécule de butanal tourne et vibre constamment; et ajouté le fait qu'il a un dipôle permanent, cela permet à ses interactions d'être suffisamment fortes pour bouillir à 74,8 ° C..
Propriétés
Noms chimiques
-Butanal
-Butyraldéhyde
-1-butanal
-Butyral
-N-butyraldéhyde.
Formule moléculaire
C4H8O ou CH3CHdeuxCHdeuxCHO.
Aspect physique
C'est un liquide clair et transparent.
Odeur
Odeur caractéristique, piquante, d'aldéhyde.
Point d'ébullition
167 ° F à 760 mmHg (74,8 ° C).
Point de fusion
-146 ºF (-96,86 ºC).
point d'allumage
-Coupe fermée 8 ° F (-22 ° C).
Solubilité dans l'eau
7 g / 100 mL à 25 ºC.
Solubilité dans les solvants organiques
Miscible avec l'éthanol, l'éther, l'acétate d'éthyle, l'acétone, le toluène et de nombreux autres solvants organiques.
Densité
0,803 g / cm3 à 68 ° F.
Densité de vapeur
2,5 (par rapport à l'air pris égal à 1).
La pression de vapeur
111 mmHg à 25 ºC.
Auto-allumage
446ºF. 425 ° F (21,8 ° C).
Viscosité
0,45 cPois à 20 ° C.
Chaleur de combustion
2479,34 kJ / mol à 25 ºC.
Chaleur de vaporisation
33,68 kJ / mol à 25 ºC.
Tension superficielle
29,9 dyne / cm à 24 ºC.
Seuil d'odeur
0,009 ppm.
Indice de réfraction
1,3843 à 20 ºC.
Moment dipolaire
2,72 D.
Longueurs d'onde (λ) d'absorption maximale dans l'eau
225 nm et 282 nm (lumière ultraviolette).
Polymérisation
Le butanal peut polymériser au contact d'alcalins ou d'acide, la polymérisation étant dangereuse.
Réactivité
Lorsqu'il est exposé à l'air, il s'oxyde, formant de l'acide butyrique. À une température de 230 ° C, le butanal s'enflamme spontanément avec l'air.
Condensation aldolique
Deux molécules de butanal peuvent réagir l'une avec l'autre, en présence de KOH et à une température de 6-8 ° C, pour former le composé 2-éthyl-3-hydroxyhexanol. Ce type de composé est appelé aldol, car il a dans sa structure un groupe aldéhyde et un groupe alcoolique.
La synthèse
Le butanal peut être produit par la déshydrogénation catalytique de l'alcool n-butylique; l'hydrogénation catalytique du crotonaldéhyde; et l'hydroformylation du propylène.
Applications
Industriel
-Le butanal est un solvant industriel, mais c'est aussi un intermédiaire dans la synthèse d'autres solvants; par exemple 2-éthylhexanol, n-butanol et triméthylpropane.
-Il est également utilisé comme intermédiaire dans la production de résines synthétiques, y compris le polyvinylbutyral; accélérateurs de vulcanisation du caoutchouc; fabrication de produits pharmaceutiques; produits de protection des cultures; les pesticides; les antioxydants; aides au bronzage.
-Le butanal est utilisé comme matière première pour la production d'arômes synthétiques. De plus, il est utilisé comme agent aromatisant alimentaire.
Autres
-Chez l'homme, le butanal est utilisé comme biomarqueur indiquant les dommages oxydatifs subis par les lipides, les protéines et les acides nucléiques.
-Il a été utilisé à titre expérimental, avec le formol et le glutardehyde, pour tenter de réduire le ramollissement des sabots des bovins, dû à l'exposition à l'eau, à l'urine et aux excréments des bovins eux-mêmes. Les résultats expérimentaux ont été positifs.
Des risques
Le butanal est destructeur pour les muqueuses des voies respiratoires supérieures, ainsi que pour les tissus de la peau et des yeux..
Par contact avec la peau provoque des rougeurs et des brûlures. Dans les yeux, les mêmes blessures se produisent, accompagnées de douleurs et de lésions du tissu oculaire.
L'inhalation de butanal peut avoir des conséquences graves, car il peut provoquer une inflammation et un œdème dans le larynx et les bronches; tandis que dans les poumons, il produit une pneumonie chimique et un œdème pulmonaire.
Les signes de surexposition comprennent: des sensations de brûlure dans les voies respiratoires supérieures, de la toux, une respiration sifflante, c'est-à-dire une respiration sifflante lors de la respiration; laryngite, essoufflement, maux de tête, nausées et vomissements.
L'inhalation peut être mortelle à la suite d'un spasme des voies respiratoires.
L'ingestion de butanal provoque une sensation de «brûlure» dans le tube digestif: cavité buccale, pharynx, œsophage et estomac.
Les références
- Morrison, R. T. et Boyd, R. N. (1987). Chimie organique. (5ta Édition.). Éditorial Addison-Wesley Iberoamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- PubChem. (2019). Butanal. Récupéré de: pubchem.ncbi.nim.nih.guv
- Wikipédia. (2019). Butanal. Récupéré de: es.wikipedia.org
- Livre chimique. (2017). Butanal. Récupéré de: Chemicalbook.com
- Basf. (Mai 2017). N-butyraldéhyde. [PDF]. Récupéré de: solvents.basf.com


Personne n'a encore commenté ce post.