
Structure, propriétés et utilisations du butanone
La butanone est un composé organique, en particulier une cétone, dont la formule chimique est CH3CHdeuxVoiture3. Son aspect est celui d'un liquide incolore utilisé principalement comme solvant. Possède des propriétés similaires à celles de l'acétone, mais bout à une température plus élevée et s'évapore plus lentement.
Il est produit par la déshydrogénation catalytique du 2-butanol (composé chiral). Cependant, on le retrouve à son état naturel dans la composition de certains fruits. Il fait partie des fumées des tuyaux d'échappement des véhicules et est un composant de la fumée de tabac.
C'est après l'acétone le plus simple de cette famille de composés organiques. La butanone provoque une irritation des yeux et du nez. À des doses inhabituellement élevées, il peut provoquer une irritation de la muqueuse pulmonaire. En revanche, ce liquide est considéré comme un agent précurseur des stupéfiants..
La butanone a une grande solubilité dans l'eau; mais il est également très soluble dans les solvants organiques tels que l'éthanol, l'éther, l'acétone, le benzène et le chloroforme. Cela pourrait s'expliquer par le fait que votre logarithme de la valeur P (0,29) pour le coefficient de partage octane / eau est faible.
Index des articles
- 1 Structure de la butanone
- 2 propriétés
- 2.1 Formule moléculaire
- 2.2 Noms
- 2.3 Masse molaire
- 2.4 Description physique
- 2.5 Odeur
- 2.6 Point d'ébullition
- 2.7 Point de fusion
- 2.8 Point d'éclair
- 2.9 Solubilité dans l'eau
- 2.10 Solubilité dans les solvants organiques
- 2.11 Densité
- 2.12 Densité de vapeur
- 2.13 Pression de vapeur
- 2.14 Coefficient de partage octanol / eau
- 2.15 Température d'auto-inflammation
- 2.16 Décomposition
- 2.17 Viscosité
- 2.18 Chaleur de combustion
- 2.19 Chaleur de vaporisation
- 2.20 Tension superficielle
- 2.21 Potentiel d'ionisation
- 2.22 Seuil d'odeur
- 2.23 Indice de réfraction
- 2.24 Constante de dissociation
- 2.25 Stabilité
- 3 utilisations
- 3.1 Solvant
- 3.2 Réactif
- 3.3 Ciment plastique
- 3.4 Autres utilisations
- 4 Références
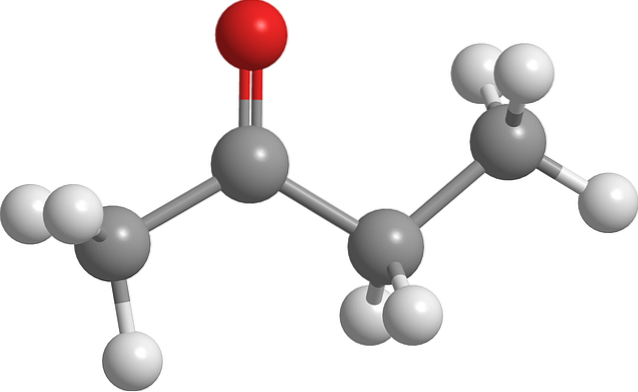
Structure de la butanone
L'image ci-dessus montre la molécule de butanone avec un modèle boule et bâton. L'atome d'oxygène du groupe carbonyle (sphère rouge) peut être vu sur le deuxième carbone. Ce groupe, C = O, est responsable de donner à la molécule un moment dipolaire permanent.
La butanone, structurellement vue, n'est rien de plus qu'une acétone à laquelle a été ajouté un groupe méthylène, CHdeux. Comme il y a plus de carbones, le moment dipolaire est plus petit que l'acétone; mais sa masse moléculaire plus élevée le fait bouillir à une température plus élevée.
Cette molécule, comme les autres cétones, n'a pas la capacité de former des liaisons hydrogène; et donc leurs interactions dipôle-dipôle ne sont pas aussi fortes.
C'est pourquoi c'est un liquide volatil. Lorsque la température baisse (-86,6 ° C), ses dipôles faibles sont ceux qui orientent ses molécules de manière ordonnée pour former un cristal. En plus de cela, on peut également dire que la butanone est structurellement asymétrique.
Propriétés
Formule moléculaire
C4H8O ou CH3VoituredeuxCH3
Des noms
- Butanone.
- 2-butanone.
- Butan-2-one.
- Méthyle éthyle cétone.
Masse molaire
72,107 g / mol.
Description physique
Liquide incolore.
Odeur
Menthe parfumée, moyennement forte.
Point d'ébullition
79,59 ° C à 760 mmHg.
Point de fusion
-86,6 ºC.
point d'allumage
-9 ºC (tasse fermée).
Solubilité dans l'eau
29 g / 100 mL à 20 ° C Bien que son moment dipolaire soit inférieur à celui de l'acétone, il peut toujours interagir à un excellent degré avec les molécules d'eau. D'eux, il reçoit des liaisons hydrogène: (CH3) (CHdeuxCH3) C = O-HOH. Pour cette raison, il est très soluble dans l'eau.
Solubilité dans les solvants organiques
Soluble dans le benzène, l'alcool et l'éther; Miscible avec les huiles, l'éthanol, l'éther, l'acétone, le benzène et le chloroforme. Notez que la butanone est soluble dans une grande variété de solvants.
Densité
0,7997 g / cm3 à 25 ºC.
Densité de vapeur
2,41 (par rapport à l'eau = 1).
La pression de vapeur
90,6 mmHg à 25 ºC.
Coefficient de partage octanol / eau
Log P = 0,29
La température d'auto-inflammation
505 ºC.
Décomposition
Il est décomposé par des processus photochimiques par oxydation par des radicaux hydroxyles libres, ainsi que par décomposition par photolyse directe. Lorsqu'il est chauffé jusqu'à la décomposition, il émet une fumée âcre.
Viscosité
0,40 cPois à 25 ° C.
Chaleur de combustion
2444,1 kJ / mol à 25 ºC.
Chaleur de vaporisation
31,30 kJ / mol au point d'ébullition; et 34,79 kJ / mol à 25 ºC.
Tension superficielle
23,97 mN / m à 25 ºC.
Potentiel d'ionisation
0,54 eV.
Seuil d'odeur
Faible odeur: 0,735 mg / m3.
Odeur élevée: 147,5 mg / m3.
Indice de réfraction
1788 à 20 ºC.
Constante de dissociation
pKa = 14,70.
Stabilité
Stable, mais hautement inflammable. Incompatible avec les agents oxydants forts, les bases et les agents réducteurs. L'humidité doit être évitée.
Applications
Solvant
La butanone est utilisée comme solvant dans la fabrication de revêtements de surface, la fabrication de poudres sans fumée, la fabrication de résines colorées et l'élimination de l'accumulation de graisse produite par les lubrifiants.
De plus, il est utilisé dans l'élaboration de:
- Cuir artificiel.
- Caoutchoucs.
- Laques.
- Vernis.
- Colles.
- Solvants.
- Décapants de peinture.
- Adhésifs.
- Ciments plastiques.
- Scellants.
- Bandes magnétiques.
- Papier transparent.
- Encres d'imprimerie.
- Cosmétiques et pharmaceutiques.
Il est également utilisé comme solvant pour le dégraissage des surfaces métalliques, les nettoyants pour équipements électroniques et l'extraction des graisses. Il est utilisé pour l'extraction de bois dur et d'huile végétale.
C'est un ingrédient inerte dans la fabrication de pesticides et dans la fabrication d'acétate de cellulose et de nitrate de cellulose.
Il est utilisé comme solvant d'extraction dans la transformation des aliments et des ingrédients alimentaires; par exemple, dans le fractionnement des graisses et des huiles, ainsi que dans le processus de décaféination du café. Également utilisé comme solvant dans les marqueurs utilisés sur les tableaux blancs.
Réactif
- La butanone est utilisée comme photoinitiateur hydrosoluble pour la photopolymérisation de l'acide méthacrylique..
- Il se condense avec le formaldéhyde pour produire de l'isopropénylcétone.
- Expérimente l'autocondensation pour la production d'éthylamylcétone.
- Réagit avec le citral pour obtenir des composants de parfum tels que la méthylpseudoionone.
- Intervient comme catalyseur dans la production d'hydrazine.
- De plus, c'est un précurseur du peroxyde de méthyléthylcétone, qui est un catalyseur pour certaines réactions de polymérisation..
Ciment plastique
Le butanone a une application en tant qu'agent de soudage plastique, avec une utilisation dans l'assemblage de modèles réduits en polystyrène. La butanone dissout le polystyrène, permettant aux bords de se rassembler lorsqu'une nouvelle polymérisation se produit. Ce comportement est celui d'un ciment et non d'une colle.
Autres utilisations
La butanone est utilisée comme stérilisateur de spores bactériennes dans les instruments chirurgicaux, les aiguilles, les injecteurs hypodermiques et les instruments dentaires..
Il est utilisé comme agent aromatisant alimentaire à de très faibles concentrations; par exemple, dans les boissons alcoolisées, la concentration est de 20 ppm; dans les produits de boulangerie, 12,7 ppm; les viandes ont environ 26,5 ppm; gomme à mâcher, 0,63 ppm; et dans les graisses et huiles, 1,0 ppm.
Et enfin, la butanone est utilisée dans la séparation de l'apoprotéine du groupe hème dans les héméprotéines..
Les références
- Morrison, R. T. et Boyd, R, N. (1987). Chimie organique. 5ta Édition. Éditorial Addison-Wesley Interamericana.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixeédition.). Wiley plus.
- Centre national d'information sur la biotechnologie. (2019). Base de données PubChem sur le méthyléthylcétone. CID = 6569. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2019). Butanone. Récupéré de: en.wikipedia.org
- Société royale de chimie. (2015). Butanone. Chemspider. Récupéré de: chemspider.com
- Arlem Cheprasov. (2019). Qu'est-ce que la butanone? Formule et utilisations. Étude. Récupéré de: study.com
- Vasler Ben. (17 mai 2017). Butanone. Monde de la chimie. Récupéré de: chemistryworld.com



Personne n'a encore commenté ce post.