
Propriétés, risques et utilisations de l'acide phosphoreux (H3PO3)

le acide phosphoreux, aussi appelé acide orthophosphoreux, c'est un composé chimique de formule H3PO3. C'est l'un des différents acides oxygénés du phosphore et sa structure est présentée dans la figure 1 (EMBL-EBI, 2015).
Compte tenu de la formule du composé, il peut être réécrit comme HPO (OH)deux. Cette espèce existe en équilibre avec un tautomère mineur P (OH)3 (Figure 2).

Les recommandations de l'IUPAC, 2005 sont que ce dernier est appelé acide phosphoreux, tandis que la forme dihydroxy est appelée acide phosphonique. Seuls les composés de phosphore réduit sont orthographiés avec une terminaison «ours»..

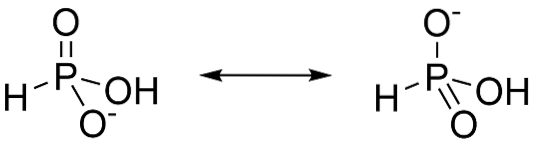
L'acide phosphoreux est un acide diprotique, cela signifie qu'il n'a la capacité de céder que deux protons. C'est parce que le tautomère majoritaire est H3PO3. Lorsque cette forme perd un proton, la résonance stabilise les anions formés, comme le montre la figure 3.
Le tautomère P (OH) 3 (figure 4) n'a pas l'avantage de stabiliser la résonance. Cela rend l'élimination du troisième proton beaucoup plus difficile (Pourquoi l'acide phosphoreux est-il diprotique et non triprotique?, 2016).

Acide phosphorique (H3PO3) forme des sels appelés phosphites, qui sont utilisés comme agents réducteurs (Britannica, 1998). Il est préparé en dissolvant de l'hexoxyde tétraphosphorique (P4OU ALORS6) selon l'équation:
P4OU ALORS6 + 6 heuresdeuxO → 4 HPO (OH)deux
Acide phosphoreux pur, H3PO3, mieux préparé par hydrolyse du trichlorure de phosphore, PCl3.
PCl3 + 3HdeuxO → HPO (OH)deux + 3HCl
La solution résultante est chauffée pour chasser le HCl, et l'eau restante est évaporée jusqu'à ce qu'elle apparaisse 3PO3 incolore cristallin au refroidissement. L'acide peut également être obtenu par l'action de l'eau sur le PBr3 ou PI3 (Zumdahl, 2018).
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 2.1 Réactivité
- 2.2 Dangers
- 2.3 Action en cas de dommage
- 3 utilisations
- 4 Références
Proprietes physiques et chimiques
L'acide phosphoreux est constitué de cristaux tétraédriques hygroscopiques blancs ou jaunes avec un arôme semblable à l'ail (National Center for Biotechnology Information, 2017).

Le H3PO3 il a un poids moléculaire de 82,0 g / mol et une densité de 1,651 g / ml. Le composé a un point de fusion de 73 ° C et se décompose au-dessus de 200 ° C. L'acide phosphoreux est soluble dans l'eau, pouvant dissoudre 310 grammes pour 100 ml de ce solvant. Il est également soluble dans l'éthanol.
De plus, c'est un acide fort avec un pKa compris entre 1,3 et 1,6 (Royal Society of Chemistry, 2015).
Le chauffage de l'acide phosphoreux à environ 200 ° C entraîne sa disproportion en acide phosphorique et en phosphine (PH3). Phosphine, un gaz qui s'enflamme normalement spontanément dans l'air.
4H3PO3 + chaleur → PH3 + 3H3PO4
Réactivité et dangers
Réactivité
- L'acide phosphoreux n'est pas un composé stable.
- Absorbe l'oxygène de l'air pour former de l'acide phosphorique.
- Forme des dépôts jaunes en solution aqueuse qui sont spontanément inflammables au séchage.
- Réagit de manière exothermique avec des bases chimiques (par exemple: amines et hydroxydes inorganiques) pour former des sels.
- Ces réactions peuvent générer des quantités de chaleur dangereusement importantes dans de petits espaces..
- La dissolution dans l'eau ou la dilution d'une solution concentrée avec de l'eau supplémentaire peut générer une chaleur importante.
- Réagit en présence d'humidité avec les métaux actifs, y compris les métaux structuraux tels que l'aluminium et le fer, pour libérer de l'hydrogène, un gaz inflammable.
- Il peut initier la polymérisation de certains alcènes. Réagit avec les composés de cyanure pour libérer du cyanure d'hydrogène gazeux.
- Peut générer des gaz inflammables et / ou toxiques au contact des dithiocarbamates, des isocyanates, des mercaptans, des nitrures, des nitriles, des sulfures et des agents réducteurs puissants.
- D'autres réactions génératrices de gaz se produisent avec les sulfites, les nitrites, les thiosulfates (pour donner H2S et SO3), les dithionites (pour donner du SO2) et les carbonates (pour donner du CO2) (ACIDE PHOSPHOREUX, 2016).
Les dangers
- Le composé est corrosif pour les yeux et la peau.
- Le contact avec les yeux peut entraîner des lésions cornéennes ou la cécité..
- Le contact avec la peau peut provoquer une inflammation et des cloques.
- L'inhalation de poussière provoquera une irritation des voies gastro-intestinales ou respiratoires, caractérisée par des brûlures, des éternuements et de la toux..
- Une surexposition sévère peut provoquer des lésions pulmonaires, une suffocation, une perte de conscience ou la mort (Fiche de données de sécurité Acide phosphoreux, 2013).
Action en cas de dommage
- S'assurer que le personnel médical connaît les matériaux impliqués et prend des précautions pour se protéger.
- La victime doit être déplacée dans un endroit frais et le service médical d'urgence appelé.
- La respiration artificielle doit être pratiquée si la victime ne respire pas.
- La méthode du bouche-à-bouche ne doit pas être utilisée si la victime a ingéré ou inhalé la substance..
- La respiration artificielle est pratiquée à l'aide d'un masque de poche équipé d'une valve unidirectionnelle ou d'un autre dispositif médical respiratoire approprié.
- De l'oxygène doit être administré si la respiration est difficile.
- Les vêtements et chaussures contaminés doivent être enlevés et isolés.
- En cas de contact avec la substance, rincer immédiatement la peau ou les yeux à l'eau courante pendant au moins 20 minutes..
- Pour moins de contact avec la peau, évitez d'étaler le matériau sur une peau non affectée..
- Gardez la victime calme et au chaud.
- Les effets de l'exposition (inhalation, ingestion ou contact avec la peau) à la substance peuvent être différés.
Applications
L'utilisation la plus importante de l'acide phosphoreux est la production de phosphites qui sont utilisés dans le traitement de l'eau. L'acide phosphorique est également utilisé pour préparer des sels de phosphite, tels que le phosphite de potassium..
Les phosphites se sont révélés efficaces pour lutter contre diverses maladies des plantes.
En particulier, le traitement par injection tronc ou foliaire contenant des sels d'acide phosphoreux est indiqué en réponse aux infections par des phytopathogènes de type phytoftera et pythium (ils provoquent la décomposition des racines).
L'acide phosphoreux et les phosphites sont utilisés comme agents réducteurs dans l'analyse chimique. Une nouvelle synthèse pratique et évolutive d'acides phénylacétiques, par la réduction catalysée par l'iodure des acides mandéliques, est basée sur la génération in situ d'acide iodhydrique à partir d'iodure de sodium catalytique. Pour cela, l'acide phosphorique est utilisé comme réducteur stoechiométrique (Jacqueline E. Milne, 2011).
Il est utilisé comme ingrédient pour la production d'additifs utilisés dans l'industrie du polychlorure de vinyle (acide phosphoreux (CAS RN 10294-56-1), 2017). Les esters d'acide phosphoreux sont également utilisés dans diverses réactions de synthèse organique (Blazewska, 2009).
Les références
- Blazewska, K. (2009). Science of Synthesis: Méthodes Houben-Weyl de Transformations Moléculaires Vol 42. New York: Thieme.
- (1998, 20 juillet). Acide phosphoreux (H3PO3). Récupéré de l'Encyclopædia Britannica: britannica.com.
- EMBL-EBI. (2015, 20 juillet). acide phosphonique. Récupéré de ebi.ac.uk: ebi.ac.uk.
- Jacqueline E. Milne, T. S. (2011). Réductions catalysées par l'iodure: développement d'une synthèse d'acides phénylacétiques. Org. Chem 76, 9519-9524. Organic-chemistry.org.
- Fiche signalétique Acide phosphoreux. (2013, 21 mai). Récupéré de sciencelab: sciencelab.com.
- Centre national d'information sur la biotechnologie. (2017, 11 mars). Base de données des composés PubChem; CID = 107909. Récupéré de PubChem: ncbi.nlm.nih.gov.
- Acide phosphoreux (CAS RN 10294-56-1). (2017, 15 mars). Récupéré de gov.uk/trade-tariff:gov.uk.
- ACIDE PHOSPHOREUX. (2016). Récupéré de caméochimiques: cameochemicals.noaa.gov.
- Société royale de chimie. (2015). ACIDE PHOSPHOREUX. Récupéré de chemspider: chemspider.com.
- Pourquoi l'acide phosphoreux est-il diprotique et non triprotique? (2016, 11 mars). Récupéré de chemistry.stackexchange.
- Zumdahl, S. S. (15 août 2018). Oxacide. Récupéré de britannica.com.



Personne n'a encore commenté ce post.