
Formules absorbées par la chaleur, comment la calculer et exercices résolus
le chaleur absorbée Il est défini comme le transfert d'énergie entre deux corps à des températures différentes. Celui avec une température plus basse absorbe la chaleur de celui avec une température plus élevée. Lorsque cela se produit, l'énergie thermique de la substance qui absorbe la chaleur augmente et les particules qui la composent vibrent plus rapidement, augmentant leur énergie cinétique..
Cela peut entraîner une augmentation de la température ou un changement d'état. Par exemple, passez du solide au liquide, comme la glace quand elle fond au contact de l'eau ou de la soude à température ambiante.

Grâce à la chaleur, il est également possible pour les objets de changer leurs dimensions. La dilatation thermique est un bon exemple de ce phénomène. Lorsque la plupart des substances sont chauffées, elles subissent généralement une augmentation de leurs dimensions.
L'eau constitue une exception à cette règle. La même quantité d'eau liquide augmente son volume lorsqu'elle refroidit en dessous de 4 ºC. De plus, les changements de température peuvent également subir des changements de densité, ce qui est également très observable dans le cas de l'eau..
Index des articles
- 1 De quoi il s'agit et ses formules
- 1.1 Calories
- 2 Comment le calculer?
- 2.1 Le bilan énergétique
- 3 Exercice résolu
- 3.1 Approche
- 3.2 Données
- 4 Références
De quoi il s'agit et formules
Dans le cas de l'énergie en transit, les unités de chaleur absorbée sont les Joules. Cependant, pendant longtemps, la chaleur avait ses propres unités: la calorie.
Aujourd'hui encore, cette unité est utilisée pour quantifier le contenu énergétique des aliments, bien qu'en réalité une calorie alimentaire corresponde à une kilocalorie de chaleur.
Calories
La calorie, abrégée en chaux, est la quantité de chaleur nécessaire pour augmenter la température de 1 gramme d'eau de 1 º C.
Au XIXe siècle, Sir James Prescott Joule (1818-1889) a mené une expérience célèbre dans laquelle il a réussi à transformer le travail mécanique en chaleur, obtenant l'équivalence suivante:
1 calorie = 4,186 Joules
Dans les unités britanniques, l'unité de chaleur est appelée Btu (Unité thermique britannique), qui est définie comme la quantité de chaleur nécessaire pour augmenter la température d'une livre d'eau de 1 ° F.
L'équivalence entre les unités est la suivante:
1 Btu = 252 calories
Le problème avec ces unités plus anciennes est que la quantité de chaleur dépend de la température. Autrement dit, celle requise pour passer de 70 ° C à 75 ° C n'est pas la même que celle requise pour chauffer l'eau de 9 ° C à 10 ° C, par exemple..
C'est pourquoi la définition envisage des plages bien définies: de 14,5 à 15,5 ° C et de 63 à 64 ° F respectivement pour la calorie et le Btu..
De quoi dépend la quantité de chaleur absorbée?
La quantité de chaleur absorbée par un matériau dépend de plusieurs facteurs:
- Masse. Plus la masse est grande, plus elle est capable d'absorber de chaleur.
- Caractéristiques de la substance. Il existe des substances qui, selon leur structure moléculaire ou atomique, sont capables d'absorber plus de chaleur que d'autres..
- Température. L'ajout de chaleur est nécessaire pour obtenir une température plus élevée.
La quantité de chaleur, notée Q, il est proportionnel aux facteurs décrits. Par conséquent, il peut être écrit comme suit:
Q = m.c.ΔT
Où m est la masse de l'objet, c est un appel constant chaleur spécifique, une propriété intrinsèque de la substance et ΔT est la variation de température obtenue en absorbant la chaleur.
ΔT = TF - Tou alors
Cette différence a un signe positif, car lors de l'absorption de chaleur, on s'attend à ce que TF > Tou alors. Cela se produit à moins que la substance ne subisse un changement de phase, tel que l'eau passant du liquide à la vapeur. Lorsque l'eau bout, sa température reste constante à environ 100 ° C, quelle que soit la vitesse à laquelle elle bout..
Comment le calculer?
En mettant en contact deux objets à des températures différentes, au bout d'un moment, ils atteignent tous les deux l'équilibre thermique. Ensuite, les températures s'équilibrent et le transfert de chaleur cesse. La même chose se produit si plus de deux objets entrent en contact. Après un certain temps, ils seront tous à la même température.
En supposant que les objets en contact forment un système fermé, d'où la chaleur ne peut pas s'échapper, le principe de conservation de l'énergie s'applique, on peut donc affirmer que:
Q absorbé = - Q a abouti
Cela représente un bilan énergétique, similaire à celui des revenus et dépenses d'une personne. Pour cette raison, la chaleur transférée a un signe négatif, car pour l'objet qui cède, la température finale est inférieure à la température initiale. Donc:
ΔT = TF - Tou alors < 0
L'équation Q absorbé = - Q a abouti il est utilisé chaque fois que deux objets sont en contact.
Bilan énergétique
Pour réaliser le bilan énergétique il faut distinguer les objets qui absorbent la chaleur de ceux qui cèdent, puis:
Σ Qk= 0
Autrement dit, la somme des gains et des pertes d'énergie dans un système fermé doit être égale à 0.
La chaleur spécifique d'une substance
Pour calculer la quantité de chaleur absorbée, il est nécessaire de connaître la chaleur spécifique de chaque substance participante. Il s'agit de la quantité de chaleur nécessaire pour élever la température de 1 g de matériau de 1 ° C. Ses unités dans le système international sont: Joule / kg. K.
Il existe des tableaux avec la chaleur spécifique de nombreuses substances, généralement calculés à l'aide d'un calorimètre ou d'outils similaires..
Un exemple de calcul de la chaleur spécifique d'un matériau
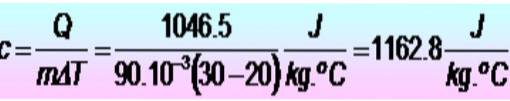
250 calories sont nécessaires pour élever la température d'un anneau métallique de 20 à 30 ºC. Si l'anneau a une masse de 90 g. Quelle est la chaleur spécifique du métal dans les unités SI??
Solution
Les unités sont converties en premier:
Q = 250 calories = 1046,5 J
m = 90 g = 90 x 10-3 kg
Exercice résolu
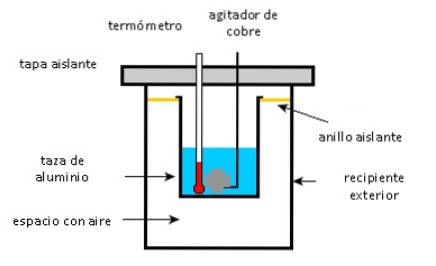
Une coupelle en aluminium contient 225 g d'eau et un agitateur en cuivre de 40 g, le tout à 27 ° C. Un échantillon de 400 g d'argent à une température initiale de 87 ° C est placé dans l'eau.
L'agitateur est utilisé pour agiter le mélange jusqu'à ce qu'il atteigne sa température finale d'équilibre de 32 ° C. Calculez la masse de la coupelle en aluminium, en considérant qu'il n'y a pas de pertes de chaleur dans l'environnement.
Approcher
Comme indiqué ci-dessus, il est important de distinguer les objets qui cèdent de la chaleur de ceux qui absorbent:
- La tasse en aluminium, l'agitateur en cuivre et l'eau absorbent la chaleur.
- L'échantillon d'argent donne de la chaleur.
Données
Les chaleurs spécifiques de chaque substance sont fournies:
- Argent: c = 234 J / kg. ºC
- Cuivre: c = 387 J / kg. ºC
- Aluminium c = 900 J / kg. ºC
- Eau c = 4186 J / kg. ºC
La chaleur absorbée ou transférée par chaque substance est calculée à l'aide de l'équation:
Q = m.c.λT
Solution
Argent
Q a abouti = 400 x 10 -3 . 234 x (32 à 87) J = -5148 J
Agitateur en cuivre
Q absorbé = 40 x 10 -3 . 387 x (32 à 27) J = 77,4 J
L'eau
Q absorbé = 225 x 10 -3 . 4186 x (32 à 27) J = 4709,25 J
Mug en aluminium
Q absorbé = m aluminium . 900 x (32 à 27) J = 4500 .m aluminium
Faire usage de:
Σ Qk= 0
77,4 + 4709,25 + 4500 .m aluminium = - (-5148)
Enfin la masse de l'aluminium est dégagée:
m aluminium = 0,0803 kg = 80,3 g
Les références
- Giancoli, D. 2006. Physique: principes avec applications. 6e. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Physique: un regard sur le monde. 6ta Edition abrégée. Apprentissage Cengage. 156 - 164.
- Rex, A. 2011. Fondamentaux de la physique. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Physique universitaire et physique moderne. 14e. Volume 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Principes de base de la physique. 9n / A Apprentissage Cengage. 362 - 374



Personne n'a encore commenté ce post.