
Calorimétrie quelles études et applications
La calorimétrie est une technique qui détermine les changements du contenu calorique d'un système associé à un processus chimique ou physique. Il est basé sur la mesure des changements de température lorsqu'un système absorbe ou émet de la chaleur. Le calorimètre est l'équipement utilisé dans les réactions dans lesquelles un échange de chaleur est impliqué.
Ce que l'on appelle une «tasse à café» est la forme la plus simple de ce type d'appareil. Grâce à son utilisation, la quantité de chaleur impliquée dans les réactions effectuées à pression constante dans une solution aqueuse est mesurée. Un calorimètre de tasse à café se compose d'un récipient en polystyrène, qui est placé dans un bécher..

L'eau est placée dans le récipient en polystyrène, muni d'un couvercle réalisé dans le même matériau qui lui confère un certain degré d'isolation thermique. De plus, le récipient comporte un thermomètre et un agitateur mécanique..
Ce calorimètre mesure la quantité de chaleur absorbée ou émise, selon que la réaction est endothermique ou exothermique, lorsqu'une réaction a lieu dans une solution aqueuse. Le système à étudier est composé des réactifs et des produits.
Index des articles
- 1 Qu'étudie la calorimétrie?
- 2 Capacité calorifique d'un calorimètre
- 2.1 Exemple d'utilisation du calorimètre pour calculer la chaleur spécifique
- 3 Pompe calorimétrique
- 4 types de calorimètre
- 4.1 Calorimètre de titrage isotherme (CTI)
- 4.2 Calorimètre à balayage différentiel
- 5 applications
- 5.1 Utilisations de la calorimétrie par titrage isotherme
- 5.2 Utilisations de la calorimétrie différentielle à balayage
- 6 Références
Qu'est-ce que la calorimétrie étudie?
La calorimétrie étudie la relation entre l'énergie thermique associée à une réaction chimique et la façon dont elle est utilisée pour déterminer ses variables. Leurs applications dans les domaines de la recherche justifient la portée de ces méthodes.
Capacité calorique d'un calorimètre
Cette capacité est calculée en divisant la quantité de chaleur absorbée par le calorimètre par le changement de température. Cette variation est le produit de la chaleur émise lors d'une réaction exothermique, qui est égale à:
Quantité de chaleur absorbée par le calorimètre + quantité de chaleur absorbée par la solution
La variation peut être déterminée en ajoutant une quantité connue de chaleur en mesurant le changement de température. Pour cette détermination de la capacité calorique, l'acide benzoïque est généralement utilisé, car sa chaleur de combustion est connue (3227 kJ / mol).
La capacité calorique peut également être déterminée en ajoutant de la chaleur au moyen d'un courant électrique.
Exemple d'utiliser le calorimètre pour calculer la chaleur spécifique
Une barre de 95 g d'un métal est chauffée à 400 ° C, immédiatement transportée dans un calorimètre avec 500 g d'eau, initialement à 20 ° C. La température finale du système est de 24 ºC. Calculer la chaleur spécifique du métal.
Δq = m x ce x Δt
Dans cette expression:
Δq = variation de charge.
m = masse.
ce = chaleur spécifique.
Δt = variation de température.
La chaleur gagnée par l'eau est égale à la chaleur dégagée par la barre métallique.
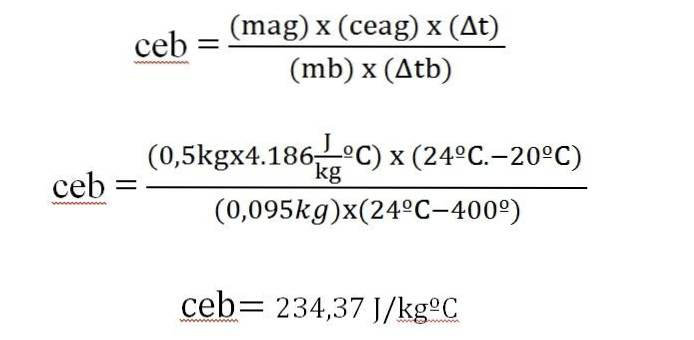
Cette valeur est similaire à celle qui apparaît dans un tableau de chaleur spécifique pour l'argent (234 J / kg ºC).
Ainsi, l'une des applications de la calorimétrie est la coopération pour l'identification des matériaux.
Pompe calorimétrique
Il se compose d'un récipient en acier, appelé pompe, résistant aux hautes pressions qui peuvent survenir lors des réactions qui se produisent dans ce récipient; ce conteneur est connecté à un circuit d'allumage pour démarrer les réactions.
La pompe est immergée dans un grand récipient avec de l'eau, dont la fonction est d'absorber la chaleur qui est générée dans la pompe pendant les réactions, ce qui réduit la variation de température. Le réservoir d'eau est équipé d'un thermomètre et d'un agitateur mécanique.
Les changements d'énergie sont mesurés à volume et température pratiquement constants, de sorte qu'aucun travail n'est effectué sur les réactions qui se produisent dans la pompe.
ΔE = q
ΔE est la variation de l'énergie interne dans la réaction et q la chaleur générée dans ce.
Types de calorimètre
Calorimètre de titrage isotherme (CTI)
Le calorimètre comporte deux cellules: dans l'une, l'échantillon est placé et dans l'autre, la référence, généralement de l'eau est placée.
La différence de température générée entre les cellules - en raison de la réaction qui se produit dans la cellule d'échantillon - est annulée par un système de rétroaction qui injecte de la chaleur pour égaliser les températures des cellules..
Ce type de calorimètre permet de suivre l'interaction entre les macromolécules et leurs ligands..
Calorimètre à balayage différentiel
Ce calorimètre comporte deux cellules, comme le CTI, mais dispose d'un dispositif qui permet de déterminer la température et les flux thermiques associés à l'évolution d'un matériau en fonction du temps.
Cette technique fournit des informations sur le repliement des protéines et des acides nucléiques, ainsi que sur leur stabilisation..
Applications

-La calorimétrie permet de déterminer l'échange de chaleur qui se produit dans une réaction chimique, permettant ainsi une meilleure compréhension du mécanisme de cette.
-En déterminant la chaleur spécifique d'un matériau, la calorimétrie fournit des données qui permettent de l'identifier.
-Comme il existe une proportionnalité directe entre le changement de chaleur d'une réaction et la concentration des réactifs, couplée au fait que la calorimétrie ne nécessite pas d'échantillons clairs, cette technique peut être utilisée pour déterminer la concentration de substances présentes dans des matrices complexes..
-Dans le domaine du génie chimique, la calorimétrie est utilisée dans le processus de sécurité, ainsi que dans différents domaines du processus d'optimisation, de la réaction chimique et dans l'unité opérationnelle..
Utilisations de la calorimétrie par titrage isotherme
-Il collabore à la mise en place du mécanisme d'action enzymatique, ainsi qu'à sa cinétique. Cette technique peut mesurer les réactions entre molécules, déterminer l'affinité de liaison, la stoechiométrie, l'enthalpie et l'entropie en solution sans avoir besoin de marqueurs..
-Évalue l'interaction des nanoparticules avec les protéines et, en conjonction avec d'autres méthodes analytiques, est un outil important pour enregistrer les changements de conformation dans les protéines.
-Il a une application dans la conservation des aliments et des cultures.
-En ce qui concerne la conservation des aliments, vous pouvez déterminer leur détérioration et leur durée de conservation (activité microbiologique). Il peut comparer l'efficacité de différentes méthodes de conservation des aliments, et est capable de déterminer la dose optimale de conservateurs, ainsi que la dégradation dans le contrôle de l'emballage.
-Quant aux cultures maraîchères, vous pouvez étudier la germination de la graine. Étant dans l'eau et en présence d'oxygène, ils dégagent de la chaleur qui peut être mesurée avec un calorimètre isotherme. Examiner l'âge et le mauvais stockage des graines et étudier leur taux de croissance face aux variations de température, de pH ou de différents produits chimiques.
-Enfin, vous pouvez mesurer l'activité biologique des sols. De plus, il peut détecter les maladies.
Utilisations de la calorimétrie différentielle à balayage
-Associée à la calorimétrie isotherme, elle a permis d'étudier l'interaction des protéines avec leurs ligands, l'interaction allostérique, le repliement des protéines et le mécanisme de leur stabilisation..
-La chaleur qui est libérée ou absorbée lors d'un événement de liaison moléculaire peut être directement mesurée.
-La calorimétrie différentielle à balayage est un outil thermodynamique pour l'établissement direct de l'absorption d'énergie thermique qui se produit dans un échantillon. Cela permet d'analyser les facteurs impliqués dans la stabilité de la molécule protéique..
-Il étudie également la thermodynamique de la transition de repliement de l'acide nucléique. La technique permet la détermination de la stabilité à l'oxydation de l'acide linoléique isolé et couplé à d'autres lipides.
-La technique est appliquée à la quantification de nanosolides à usage pharmaceutique et à la caractérisation thermique de transporteurs lipidiques nanostructurés..
Les références
- Whitten, K., Davis, R., Peck, M. et Stanley, G. Chimie. (2008). 8e éd. Cengage Learning Modifier.
- Rehak, N. N. et Young, D. S. (1978). Applications prospectives de la calorimétrie en laboratoire clinique. Clin. Chem.24 (8): 1414-1419.
- Stossel, F. (1997). Applications de la calorimétrie réactionnelle en génie chimique. J. Therm. Anal. 49 (3): 1677-1688.
- Weber, P. C. et Salemme, F. R. (2003). Applications des méthodes calorimétriques à la découverte de médicaments et à l'étude des interactions protéiques. Curr. Opin. Struct. Biol.13 (1): 115-121.
- Gill, P., Moghadem, T. et Ranjbar, B. (2010). Techniques calorimétriques à balayage différentiel: applications en biologie et nanosciences. J. Biol. Tech.21 (4): 167-193.
- Omanovic-Miklicanin, E., Manfield, I. et Wilkins, T. (2017). Applications de la calorimétrie par titrage isotherme dans l'évaluation des interactions protéine-nanoparticule. J. Therm. Anal. 127: 605-613.
- Consortium des collèges communautaires pour les diplômes en bioscience. (7 juillet 2014). Calorimètre de tasse de café. [Chiffre]. Extrait le 7 juin 2018 de: commons.wikimedia.org


Personne n'a encore commenté ce post.