
Historique du calorimètre, pièces, types et leurs caractéristiques
le calorimètre est un appareil utilisé pour mesurer le changement de température d'une quantité de substance (généralement de l'eau) de chaleur spécifique connue. Ce changement de température est dû à la chaleur absorbée ou libérée dans le procédé à l'étude; chimique s'il s'agit d'une réaction, ou physique s'il s'agit d'un changement de phase ou d'état.
Dans le laboratoire, le calorimètre le plus simple que l'on puisse trouver est celui du verre à café. Il est utilisé pour mesurer la chaleur absorbée ou libérée lors d'une réaction à pression constante, en solution aqueuse. Les réactions sont sélectionnées pour éviter l'intervention de réactifs ou de produits gazeux.
Quantité de chaleur dégagée lors de la réaction = quantité de chaleur absorbée par le calorimètre + quantité de chaleur absorbée par la solution
La quantité de chaleur absorbée par le calorimètre est appelée la capacité calorimétrique du calorimètre. Ceci est déterminé en fournissant une quantité connue de chaleur au calorimètre avec une masse d'eau donnée. Ensuite, l'augmentation de la température du calorimètre et de la solution contenant.
Avec ces données et l'utilisation de la chaleur spécifique de l'eau (4,18 J / g.ºC), la capacité calorique du calorimètre peut être calculée. Cette capacité est également appelée constante du calorimètre.
Par contre, la chaleur gagnée par la solution aqueuse est égale à m · ce · Δt. Dans la formule m = masse d'eau, ce = chaleur spécifique de l'eau et Δt = variation de température. Sachant tout cela, vous pouvez alors calculer la quantité de chaleur dégagée par la réaction exothermique.
Index des articles
- 1 Histoire du calorimètre
- 2 pièces
- 3 Types et leurs caractéristiques
- 3.1 Le verre de café
- 3.2 La bombe calorimétrique
- 3.3 Le calorimètre adiabatique
- 3.4 Le calorimètre à isopéribol
- 3.5 Le calorimètre à flux
- 3.6 Le calorimètre pour la calorimétrie différentielle à balayage
- 4 applications
- 4.1 En physicochimie
- 4.2 Dans les systèmes biologiques
- 4.3 Calorimètre de la pompe à oxygène et puissance calorique
- 5 Références
Histoire du calorimètre
En 1780, A. L. Lavoisier, chimiste français, considéré comme l'un des pères de la chimie, utilisait un cobaye pour mesurer la production de chaleur par sa respiration.
Comment? Utilisation d'un appareil similaire à un calorimètre. La chaleur produite par le cobaye a été mise en évidence par la fonte de la neige qui entourait l'appareil.
Les chercheurs A. L Lavoisier (1743-1794) et P. S. Laplace (1749-1827) ont conçu un calorimètre utilisé pour mesurer la chaleur spécifique d'un corps par la méthode de la fonte de la glace..
Le calorimètre se composait d'une coupelle cylindrique en étain verni, soutenue par un trépied et terminée intérieurement par un entonnoir. À l'intérieur, un autre verre était placé, semblable au précédent, avec un tube qui traversait la chambre extérieure et qui était muni d'une clé. À l'intérieur du deuxième verre se trouvait une grille.
L'être ou l'objet dont la chaleur spécifique devait être déterminée était placé sur cette grille. De la glace a été placée à l'intérieur des verres concentriques, comme dans le panier.
La chaleur produite par le corps a été absorbée par la glace, la faisant fondre. Et le produit d'eau liquide de la fonte de la glace a été collecté, ouvrant le robinet en verre interne.
Et enfin, l'eau pesait, la masse de la glace fondue était connue.
les pièces
Le calorimètre le plus utilisé dans les laboratoires d'enseignement de la chimie est ce qu'on appelle le calorimètre à tasse à café. Ce calorimètre se compose d'un bécher, ou à la place, d'un récipient en matériau d'anime qui possède certaines propriétés isolantes. À l'intérieur de ce récipient, la solution aqueuse est placée avec le corps qui va produire ou absorber la chaleur.
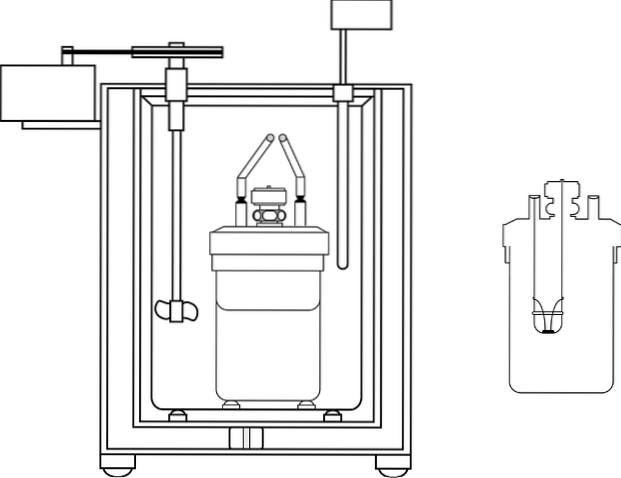
Un couvercle en matériau isolant à deux trous est placé sur la partie supérieure du récipient. Dans l'un, un thermomètre est inséré pour mesurer les changements de température, et dans l'autre un agitateur, de préférence en verre, qui remplit la fonction de déplacer le contenu de la solution aqueuse..
L'image montre les pièces d'un calorimètre à bombe; Cependant, on peut voir qu'il possède le thermomètre et l'agitateur, éléments communs à plusieurs calorimètres.
Types et leurs caractéristiques
La tasse de café
C'est celui qui est utilisé dans la détermination de la chaleur dégagée par une réaction exothermique, et de la chaleur absorbée dans une réaction endothermique..
De plus, il peut être utilisé pour déterminer la chaleur spécifique d'un corps; c'est-à-dire la quantité de chaleur qu'un gramme de substance doit absorber pour augmenter sa température d'un degré Celsius. .
La bombe calorimétrique
C'est un appareil dans lequel la quantité de chaleur qui est dégagée ou absorbée dans une réaction qui se produit à volume constant est mesurée.
La réaction a lieu dans un récipient en acier robuste (la pompe), qui est immergé dans un grand volume d'eau. Cela permet de limiter les changements de température de l'eau. Par conséquent, on suppose que les changements associés à la réaction sont mesurés à volume et température constants..
Ce qui précède indique qu'aucun travail n'est effectué lorsqu'une réaction est effectuée dans un calorimètre à bombe.
La réaction commence par fournir de l'électricité via des câbles connectés à la pompe.
Le calorimètre adiabatique
Il se caractérise par une structure isolante appelée bouclier. Le bouclier est situé autour de la cellule où se produisent des changements de chaleur et de température. De même, il est connecté à un système électronique qui maintient sa température très proche de celle de la cellule, pour éviter les transferts de chaleur..
Dans un calorimètre adiabatique, la différence de température entre le calorimètre et son environnement est minimisée; ainsi que de minimiser le coefficient de transfert de chaleur et le temps d'échange de chaleur.
Ses parties se composent des éléments suivants:
-La cellule (ou conteneur), intégrée dans un système d'isolation au moyen duquel elle essaie d'éviter les déperditions de chaleur.
-Le thermomètre, pour mesurer les changements de température.
-Un appareil de chauffage, connecté à une source de tension électrique contrôlable.
-Et le bouclier, déjà mentionné.
Dans ce type de calorimètre, des propriétés telles que l'entropie, la température de Debye et la densité électronique d'état peuvent être déterminées..
Le calorimètre isopéribol
C'est un appareil dans lequel la cellule de réaction et la pompe sont immergées dans une structure appelée enveloppe. Dans ce cas, la soi-disant veste est constituée d'eau, maintenue à une température constante.
Les températures des cellules et des pompes augmentent à mesure que la chaleur est libérée pendant le processus de combustion mais la température de la chemise d'eau est maintenue à une température fixe.
Un microprocesseur contrôle la température de la cellule et de la chemise, apportant les corrections nécessaires à la chaleur de fuite qui résulte des différences entre les deux températures..
Ces corrections sont appliquées en continu, et avec une correction finale, basée sur des mesures avant et après le test..
Le calorimètre à flux
Développé par Caliendar, il dispose d'un dispositif permettant de déplacer un gaz dans un conteneur à vitesse constante. En ajoutant de la chaleur, l'augmentation de la température dans le fluide est mesurée.
Le calorimètre à flux est caractérisé par:
- Une mesure précise de la vitesse de débit constant.
- Mesure précise de la quantité de chaleur introduite dans le fluide par un réchauffeur.
- Une mesure précise de l'augmentation de la température du gaz causée par l'apport d'énergie
- Une conception pour mesurer la capacité d'un gaz sous pression.
Le calorimètre pour la calorimétrie différentielle à balayage
Il se caractérise par la présence de deux récipients: dans l'un, l'échantillon à étudier est placé, tandis que l'autre est maintenu vide ou un matériau de référence est utilisé..
Les deux cuves sont chauffées à un taux d'énergie constant, au moyen de deux radiateurs indépendants. Lorsque les deux cuves commencent à chauffer, l'ordinateur trace la différence de flux de chaleur des radiateurs par rapport à la température, permettant ainsi de déterminer le flux de chaleur..
En outre, la variation de la température en fonction du temps peut être déterminée; et enfin, la capacité calorique.
Applications
En physicochimie
-Les calorimètres de base, de type tasse à café, permettent de mesurer la quantité de chaleur qu'un corps dégage ou absorbe. En eux, il est possible de déterminer si une réaction est exothermique ou endothermique. De plus, la chaleur spécifique d'un corps peut être déterminée.
-Avec le calorimètre adiabatique, il a été possible de déterminer l'entropie d'un processus chimique et la densité électronique de l'état.
Dans les systèmes biologiques
-Les microcalorimètres sont utilisés pour étudier les systèmes biologiques qui incluent les interactions entre les molécules, ainsi que les changements de conformation moléculaire qui se produisent; par exemple, dans le déploiement d'une molécule. La ligne comprend à la fois un balayage différentiel et un titrage isotherme.
-Le microcalorimètre est utilisé dans le développement de médicaments à petites molécules, de biothérapies et de vaccins.
Calorimètre de pompe à oxygène et puissance calorique
Dans le calorimètre à bombe à oxygène, la combustion de nombreuses substances a lieu et sa valeur calorique peut être déterminée. Parmi les substances étudiées à l'aide de ce calorimètre figurent: le charbon et le coke; huiles comestibles, lourdes et légères; l'essence et tous les carburants.
Ainsi que les types de combustibles pour les réacteurs d'aéronefs; déchets de combustible et élimination des déchets; produits alimentaires et compléments alimentaires pour la nutrition humaine; cultures fourragères et compléments alimentaires pour animaux; matériaux de construction; carburants et propulseurs pour fusées.
De même, le pouvoir calorique a été déterminé par calorimétrie dans les études thermodynamiques des matériaux combustibles; dans l'étude du bilan énergétique en écologie; dans les explosifs et les poudres thermiques et dans l'enseignement des méthodes thermodynamiques de base.
Les références
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE.
- González J., Cortés L. et Sánchez A. (s.f.). Calorimétrie adiabatique et ses applications. Récupéré de: cenam.mx
- Wikipédia. (2018). Calorimètre. Récupéré de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 juin 2018). Définition du calorimètre en chimie. Récupéré de: thinkco.com
- Gillespie, Claire. (11 avril 2018). Comment fonctionne un calorimètre? Découvrir. Récupéré de: scaimer.com



Personne n'a encore commenté ce post.