
Formules et unités de Charles Law, expérience, exercices
La loi charles ou Guy-Lussac est celui qui permet d'énoncer l'une des propriétés de l'état gazeux: le volume qu'un gaz occupe est directement proportionnel à la température à pression constante.
Cette proportionnalité est linéaire pour toutes les plages de température si le gaz en question est idéal; les gaz réels, en revanche, s'écartent de la tendance linéaire à des températures proches de leur point de rosée. Cependant, cela n'a pas limité l'utilisation de cette loi pour une myriade d'applications impliquant des gaz..

L'une des applications par excellence de la loi de Charles est dans les ballons à air. D'autres ballons plus simples, comme ceux de souhaits, également appelés lanternes chinoises (image du haut), révèlent la relation entre le volume et la température d'un gaz à pression constante.
Pourquoi à pression constante? Car si la pression augmentait, cela signifierait que le conteneur où se trouve le gaz est hermétiquement fermé; et avec cela, les collisions ou impacts des particules gazeuses contre les parois internes dudit récipient augmenteraient (loi de Boyle-Mariotte).
Par conséquent, il n'y aurait aucun changement dans le volume occupé par le gaz, et la loi de Charles ferait défaut. Contrairement à un contenant hermétique, le tissu des ballons de souhaits représente une barrière mobile, capable de se dilater ou de se contracter en fonction de la pression exercée par le gaz à l'intérieur..
Cependant, à mesure que le tissu des ballons se dilate, la pression interne du gaz reste constante car la zone sur laquelle ses particules entrent en collision augmente. Plus la température du gaz est élevée, plus l'énergie cinétique des particules est élevée, et donc le nombre de collisions.
Et à mesure que le ballon se dilate à nouveau, les collisions contre ses parois internes restent (idéalement) constantes..
Ainsi, plus le gaz est chaud, plus la dilatation du ballon est grande et plus elle s'élèvera. Le résultat: des lumières rougeâtres (quoique dangereuses) suspendues dans le ciel les nuits de décembre..
Index des articles
- 1 Quelle est la loi de Charles?
- 1.1 Déclaration
- 1.2 Emplois
- 1.3 Graphique
- 2 Formules et unités de mesure
- 2.1 Formules
- 2.2 Unités
- 3 Expérience pour prouver la loi
- 3.1 Montage
- 3.2 Développement
- 3.3 Ballon avec de la glace en hiver
- 4 exercices résolus
- 4.1 Exercice 1
- 4.2 Exercice 2
- 4.3 Exercice 3
- 5 applications
- 5.1 Ballons de souhaits
- 5.2 Thermomètres pop-up ou à dinde
- 5.3 Restauration de la forme des balles de ping-pong
- 5.4 Préparation des pains
- 6 Références
Quelle est la loi de Charles?
Déclaration
La loi dite de Charles ou loi de Gay-Lussac explique la dépendance qui existe entre le volume occupé par un gaz et la valeur de sa température absolue ou température Kelvin..
La loi peut être énoncée comme suit: si la pression reste constante, il s'ensuit que «pour une masse donnée d'un gaz, elle augmente son volume d'environ 1/273 fois son volume à 0 ºC, pour chaque degré centigrade (1 ºC) augmenter sa température ".
Emplois
Les travaux de recherche qui ont établi la loi ont été lancés dans les années 1780 par Jacques Alexander Cesar Charles (1746-1823). Cependant, Charles n'a pas publié les résultats de ses recherches..
Plus tard, John Dalton en 1801 a réussi à déterminer expérimentalement que tous les gaz et vapeurs, étudiés par lui, se dilatent entre deux températures déterminées dans la même quantité volumique. Ces résultats ont été confirmés par Gay-Lussac en 1802.
Les travaux de recherche de Charles, Dalton et Gay-Lussac, ont permis d'établir que le volume occupé par un gaz et sa température absolue sont directement proportionnels. Par conséquent, il existe une relation linéaire entre la température et le volume d'un gaz.
Graphique
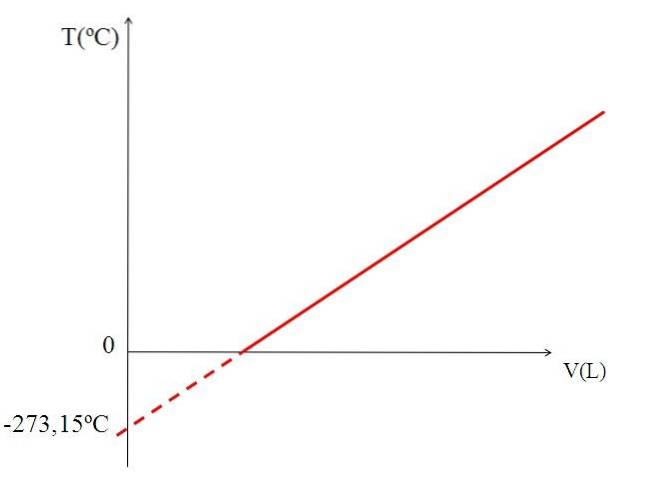
La représentation graphique (image du haut) du volume d'un gaz en fonction de la température produit une ligne droite. L'intersection de la droite avec l'axe X, à une température de 0 ºC, permet d'obtenir le volume du gaz à 0 ºC.
De même, l'intersection de la droite avec l'axe X donnerait des informations sur la température pour laquelle le volume occupé par le gaz serait nul "0". Dalton a estimé cette valeur à -266 ºC, proche de la valeur suggérée par Kelvin pour le zéro absolu (0).
Kelvin a proposé une échelle de température dont le zéro devrait être la température à laquelle un gaz parfait aurait un volume de zéro. Mais à ces basses températures les gaz se liquéfient.
C'est pourquoi il n'est pas possible de parler de volumes de gaz en tant que tels, constatant que la valeur du zéro absolu doit être de -273,15 ºC.
Formules et unités de mesure
Formules
La loi de Charles dans sa version moderne stipule que le volume et la température d'un gaz sont directement proportionnels.
Ensuite:
V / T = k
V = volume de gaz. T = température Kelvin (K). k = constante de proportionnalité.
Pour un volume V1 et une température T1
k = V1 / T1
De même, pour un volume Vdeux et une température Tdeux
k = Vdeux / Tdeux
Alors, en assimilant les deux équations pour k nous avons
V1 / T1 = Vdeux / Tdeux
Cette formule peut s'écrire comme suit:
V1 Tdeux = Vdeux T1
Résoudre pour Vdeux, vous obtenez la formule:
Vdeux = V1 Tdeux / T1
Unités
Le volume du gaz peut être exprimé en litres ou dans l'une de ses unités dérivées. De même, le volume peut être exprimé en mètres cubes ou en toute unité dérivée. La température doit être exprimée en température absolue ou température Kelvin.
Ainsi, si les températures d'un gaz sont exprimées en degrés centigrades ou en échelle Celsius, pour effectuer un calcul avec eux, il faudrait ajouter la quantité de 273,15 ºC aux températures, afin de les amener à des températures absolues ou kelvin..
Si les températures sont exprimées en degrés Fahrenheit, il faudrait ajouter 459,67 ºR à ces températures, pour les amener à des températures absolues sur l'échelle de Rankine..
Une autre formule bien connue de la loi de Charles, et directement liée à son énoncé, est la suivante:
Vt = Vou alors (1 + t / 273)
Où Vt est le volume occupé par un gaz à une certaine température, exprimé en litres, cm3, etc.; et Vou alors est le volume occupé par un gaz à 0 ºC. Pour sa part, t est la température à laquelle le volume est mesuré, exprimée en degrés centigrades (ºC).
Et enfin, 273 représente la valeur du zéro absolu sur l'échelle de température Kelvin.
Expérience pour prouver la loi
Montage
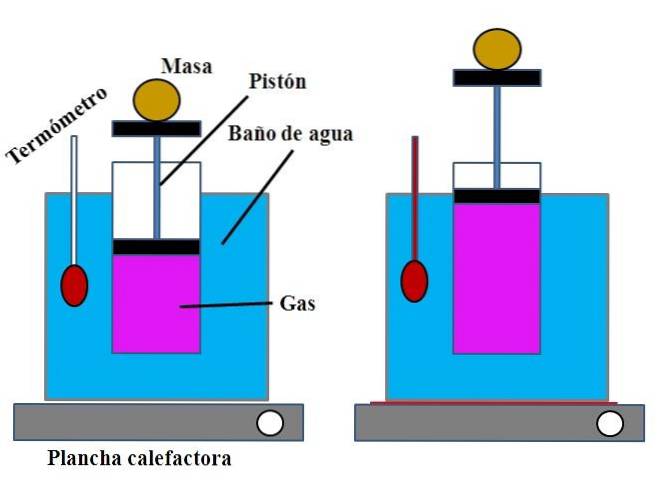
Dans un récipient d'eau, qui remplissait la fonction d'un bain-marie, un cylindre ouvert était placé en haut, avec un piston qui s'adaptait à la paroi intérieure du cylindre (image du haut).
Ce plongeur (constitué du piston et des deux embases noires) pouvait se déplacer vers le haut ou le bas du cylindre en fonction du volume de gaz qu'il contenait..
Le bain-marie pourrait être chauffé en utilisant un brûleur ou une installation de chauffage, qui fournissait la chaleur nécessaire pour augmenter la température du bain et donc la température du cylindre équipé d'un plongeur..
Une masse déterminée a été placée sur le piston afin de garantir que l'expérience a été réalisée à pression constante. La température du bain et du cylindre a été mesurée à l'aide d'un thermomètre placé dans le bain-marie..
Bien que le cylindre n'ait probablement pas de graduation pour visualiser le volume d'air, celui-ci pourrait être estimé en mesurant la hauteur atteinte par la masse placée sur le piston et la surface de la base du cylindre..
Développement
Le volume d'un cylindre est obtenu en multipliant la surface de sa base par sa hauteur. La surface de la base du cylindre pourrait être obtenue en appliquant la formule: S = Pi x rdeux.
Alors que la hauteur est obtenue en mesurant la distance entre la base du cylindre et la partie du piston sur laquelle repose la masse.
Au fur et à mesure que la température du bain augmentait par la chaleur produite par le briquet, on a observé que le piston montait à l'intérieur du cylindre. Ensuite, ils lisent sur le thermomètre la température du bain-marie, qui correspond à la température à l'intérieur du cylindre..
De même, ils ont mesuré la hauteur de la masse au-dessus du plongeur, pouvant estimer le volume d'air correspondant à la température mesurée. De cette manière, ils ont effectué plusieurs mesures de la température et des estimations du volume d'air correspondant à chacune des températures..
Avec cela, il a finalement été possible d'établir que le volume qu'occupe un gaz est directement proportionnel à sa température. Cette conclusion a permis d'énoncer la soi-disant loi de Charles.
Ballon avec de la glace en hiver
En plus de l'expérience précédente, il existe une expérience plus simple et plus qualitative: celle du ballon avec de la glace en hiver..
Si un ballon rempli d'hélium était placé dans une pièce chauffée en hiver, le ballon aurait un certain volume; Mais, s'il était plus tard déplacé à l'extérieur de la maison à basse température, on observerait que le ballon d'hélium rétrécit, réduisant son volume selon la loi de Charles..
Exercices résolus
Exercice 1
Il y a un gaz qui occupe un volume de 750 cm3 à 25 ºC: quel sera le volume qu'occupe ce gaz à 37 ºC si la pression est maintenue constante?
Il faut d'abord transformer les unités de température en kelvin:
T1 en degrés Kelvin = 25 ºC + 273,15 ºC = 298,15 K
Tdeux en degrés Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Parce que V1 et les autres variables, nous résolvons pour Vdeux et est calculé avec l'équation suivante:
Vdeux = V1 · (Tdeux / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
Exercice 2
Quelle serait la température en degrés Celsius à laquelle 3 litres d'un gaz devraient être chauffés à 32 ºC, pour que son volume atteigne 3,2 litres?
Encore une fois, les degrés centigrades sont transformés en kelvin:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Et comme dans l'exercice précédent, T est effacédeux au lieu de Vdeux, et est calculé ci-dessous:
Tdeux = Vdeux · (T1 / V1)
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Mais la déclaration demande des degrés centigrades, donc l'unité de T est modifiéedeux:
Tdeux en degrés centigrades = 325, 49 º C (K) - 273,15 ºC (K)
= 52,34 ºC
Exercice 3
Si un gaz à 0 ºC occupe un volume de 50 cm3, Quel volume occupera-t-il à 45 ºC?
En utilisant la formule originale de la loi de Charles:
Vt = Vou alors (1 + t / 273)
Nous procédons au calcul de Vt directement car toutes les variables sont disponibles:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
En revanche, si le problème est résolu en utilisant la stratégie des exemples 1 et 2, nous aurons:
Vdeux = V1 · (Tdeux / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
Le résultat, en appliquant les deux procédures, est le même car finalement elles reposent sur le même principe de la loi de Charles.
Applications
Souhaitez des ballons
Les ballons à souhaits (déjà mentionnés en introduction) sont équipés d'une matière textile imprégnée d'un liquide combustible.
Lorsque ce matériau est incendié, il y a une augmentation de la température de l'air contenu dans le ballon, ce qui provoque une augmentation du volume du gaz selon la loi de Charles..
Par conséquent, en augmentant le volume d'air dans le ballon, la densité de l'air qu'il contient diminue, ce qui devient inférieur à la densité de l'air environnant, et c'est pourquoi le ballon monte..
Thermomètres pop-up ou à dinde
Comme leur nom l'indique, ils sont utilisés lors de la cuisson des dindes. Le thermomètre a un récipient rempli d'air fermé par un couvercle et est calibré de telle sorte que lorsque la température de cuisson optimale est atteinte, le couvercle est soulevé en émettant un son..
Le thermomètre est placé à l'intérieur de la dinde et, à mesure que la température à l'intérieur du four augmente, l'air à l'intérieur du thermomètre se dilate, augmentant son volume. Ensuite, lorsque le volume de l'air atteint une certaine valeur, soulevez le couvercle du thermomètre.
Restauration de la forme des balles de ping-pong
Selon les exigences de leur utilisation, les balles de ping-pong sont légères et leurs parois en plastique sont minces. Cela fait que lorsqu'ils sont impactés par les raquettes, ils subissent des déformations.
En plaçant les billes déformées dans de l'eau chaude, l'air à l'intérieur se réchauffe et se dilate, entraînant une augmentation du volume d'air. Cela provoque également l'étirement de la paroi des balles de ping-pong, leur permettant de retrouver leur forme d'origine..
Pain
Les levures sont incorporées dans la farine de blé utilisée pour faire du pain et ont la capacité de produire du gaz carbonique..
Lorsque la température des pains augmente pendant la cuisson, le volume de dioxyde de carbone augmente. C'est à cause de cela que le pain se dilate jusqu'à atteindre le volume souhaité..
Les références
- Clark J. (2013). Autres lois sur les gaz - loi de Boyle et loi de Charles. Récupéré de: chemguide.co.uk
- Staroscik Andrew. (2018). Loi de Charles. Récupéré de: scienceprimer.com
- Wikipédia. (2019). Charles Law. Récupéré de: en.wikipedia.org
- Helmenstine, Todd. (27 décembre 2018). Quelle est la formule de la loi de Charles? Récupéré de: thinkco.com
- Prof. N. De Leon. (s.f.). Lois élémentaires du gaz: Charles Law. Notes de classe C 101. Récupéré de: iun.edu
- Briceño Gabriela. (2018). Charles Law. Récupéré de: euston96.com
- Morris, J. G. (1974). Physicochimie pour les biologistes. (deuxdonne édition). Éditorial Reverté, S.A.


Personne n'a encore commenté ce post.