
Changements des types d'états et de leurs caractéristiques (avec exemples)

Les changements d'état ou phase sont un phénomène thermodynamique où la matière subit des changements physiques réversibles. On dit qu'elle est thermodynamique car un transfert de chaleur se produit entre la matière et l'environnement; ou ce qui est pareil, il y a des interactions entre la matière et l'énergie qui induisent un réarrangement des particules.
Les particules qui subissent le changement d'état restent les mêmes avant et après le changement. La pression et la température sont des variables importantes dans la façon dont elles sont intégrées dans une phase ou une autre. Lorsqu'un changement d'état se produit, un système biphasique se forme, composé de la même matière dans deux états physiques différents.
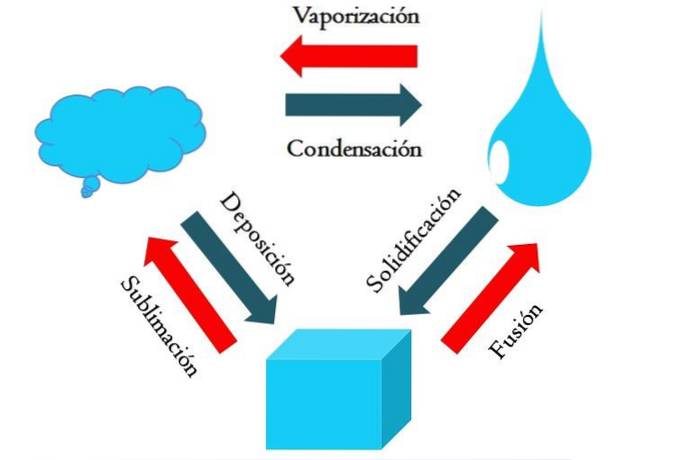
L'image ci-dessus montre les principaux changements d'état que subit la matière dans des conditions normales..
Un cube solide d'une substance bleuâtre peut devenir liquide ou gazeux en fonction de la température et de la pression de son environnement. À lui seul, il représente une seule phase: le solide. Mais, au moment de la fusion, c'est-à-dire de la fusion, un équilibre solide-liquide appelé fusion est établi (flèche rouge entre le cube bleuâtre et la goutte).
Pour que la fusion se produise, le cube doit absorber la chaleur de son environnement pour augmenter sa température; c'est donc un processus endothermique. Une fois le cube complètement fondu, il revient à une seule phase: celle de l'état liquide.
Cette goutte bleuâtre peut continuer à absorber la chaleur, ce qui augmente sa température et entraîne la formation de bulles gazeuses. Encore une fois, il y a deux phases: l'une liquide et l'autre gazeuse. Lorsque tout le liquide s'est évaporé jusqu'à son point d'ébullition, on dit alors qu'il a bouilli ou vaporisé..
Maintenant, les gouttes bleuâtres se sont transformées en nuages. Jusqu'à présent, tous les processus ont été endothermiques. Le gaz bleu peut continuer à absorber la chaleur jusqu'à ce qu'il devienne chaud; Cependant, étant donné les conditions terrestres, il a tendance à se refroidir et à se condenser dans le liquide (condensation)..
D'autre part, les nuages peuvent également être déposés directement sur une phase solide, formant à nouveau le cube solide (dépôt). Ces deux derniers processus sont exothermiques (flèches bleues); c'est-à-dire qu'ils dégagent de la chaleur dans l'environnement ou les environs.
En plus de la condensation et du dépôt, un changement d'état se produit lorsque la goutte bleuâtre gèle à basse température (solidification).
Index des articles
- 1 Types de changements d'état et leurs caractéristiques
- 1.1 - Fusion
- 1.2 - Vaporisation
- 1.3 - Condensation
- 1.4 - Solidification
- 1.5 - Sublimation
- 1.6 - Dépôt
- 2 Autres changements de statut
- 3 Références
Types de changements d'état et leurs caractéristiques
L'image montre les changements typiques pour les trois états (les plus courants) de la matière: solide, liquide et gazeux. Les changements accompagnés des flèches rouges sont endothermiques, impliquant l'absorption de chaleur; tandis que ceux accompagnés des flèches bleues sont exothermiques, ils dégagent de la chaleur.
Une brève description de chacun de ces changements sera faite ci-dessous, mettant en évidence certaines de leurs caractéristiques issues du raisonnement moléculaire et thermodynamique..
- La fusion
La fusion est le changement d'état d'une substance de solide à liquide..
A l'état solide, les particules (ions, molécules, amas, etc.) sont "prisonnières", situées dans des positions fixes dans l'espace sans pouvoir se déplacer librement. Cependant, ils sont capables de vibrer à des fréquences différentes, et s'ils sont très forts, l'ordre rigoureux imposé par les forces intermoléculaires commencera à «s'effondrer»..
En conséquence, deux phases sont obtenues: une où les particules restent confinées (solide), et une autre où elles sont plus libres (liquide), suffisamment pour augmenter les distances qui les séparent. Pour y parvenir, le solide doit absorber la chaleur, et ainsi ses particules vibreront avec une plus grande force..
Pour cette raison, la fusion est endothermique, et quand elle commence, on dit qu'un équilibre se produit entre les phases solide-liquide..
La chaleur nécessaire pour provoquer ce changement est appelée chaleur ou enthalpie molaire de fusion (ΔHFus). Cela exprime la quantité de chaleur (énergie, principalement en unités de kJ) qu'une mole de substance à l'état solide doit absorber pour fondre, et pas simplement augmenter sa température..
Boule de neige

Dans cet esprit, on comprend pourquoi une boule de neige fond dans la main (image du haut). La neige absorbe la chaleur corporelle, ce qui suffit à élever la température de la neige au-dessus de 0 ° C.
Les cristaux de glace dans la neige absorbent juste assez de chaleur pour fondre et pour que leurs molécules d'eau prennent une structure plus désordonnée. Pendant que la neige fond, l'eau formée n'augmentera pas sa température, puisque toute la chaleur de la main est utilisée par la neige pour terminer sa fonte.
- Vaporisation

La vaporisation est le changement d'état d'une substance de l'état liquide à l'état gazeux.
En continuant avec l'exemple de l'eau, en plaçant maintenant une poignée de neige dans un pot et en allumant le feu, on observe que la neige fond rapidement. Au fur et à mesure que l'eau se réchauffe, de petites bulles de dioxyde de carbone et d'autres impuretés gazeuses possibles commencent à se former à l'intérieur..

La chaleur étend moléculairement les configurations désordonnées de l'eau, en augmentant son volume et en augmentant sa pression de vapeur; par conséquent, plusieurs molécules s'échappent de la surface en raison de l'augmentation de l'évaporation.
L'eau liquide augmente lentement sa température, en raison de sa chaleur spécifique élevée (4,184J / ° C ∙ g). Il arrive un moment où la chaleur qu'il absorbe n'est plus utilisée pour élever sa température, mais pour initier l'équilibre liquide-vapeur; c'est-à-dire qu'il commence à bouillir et tout le liquide passera à l'état gazeux tout en absorbant la chaleur et en maintenant la température constante.
C'est là que vous voyez le bouillonnement intense à la surface de l'eau bouillie (image du haut). La chaleur absorbée par l'eau liquide pour que la pression de vapeur de ses bulles naissantes soit égale à la pression externe est appelée enthalpie de vaporisation (ΔHVapeur).
Le rôle de la pression
La pression est également déterminante dans les changements d'état. Quel est son effet sur la vaporisation? Que plus la pression est élevée, plus la chaleur que l'eau doit absorber pour bouillir est grande, et donc, elle s'évapore au-dessus de 100 ° C.
En effet, l'augmentation de la pression fait qu'il est difficile pour les molécules d'eau de s'échapper du liquide vers la phase gazeuse..
Les autocuiseurs utilisent ce fait à leur avantage pour chauffer les aliments dans l'eau à une température supérieure à leur point d'ébullition..
D'autre part, comme il y a un vide ou une diminution de la pression, l'eau liquide a besoin d'une température plus basse pour bouillir et passer en phase gazeuse. Avec beaucoup ou peu de pression, lorsque l'eau bout, elle doit absorber sa chaleur de vaporisation respective pour terminer son changement d'état..
- Condensation
La condensation est le changement d'état d'une substance de l'état gazeux à l'état liquide.

L'eau s'est vaporisée. Suivant? La vapeur d'eau peut encore augmenter sa température, devenant un courant dangereux capable de provoquer de graves brûlures..
Cependant, supposons qu'il refroidisse à la place. Comment? On dit que la libération de chaleur dans l'environnement et la libération de chaleur sont un processus exothermique qui se produit.
En libérant de la chaleur, les molécules d'eau gazeuses très énergétiques commencent à ralentir. De plus, leurs interactions deviennent plus efficaces à mesure que la température de la vapeur diminue. Des gouttelettes d'eau se formeront en premier, condensées de la vapeur, suivies de gouttelettes plus grosses qui finissent par être attirées par la gravité.
Pour condenser complètement une quantité donnée de vapeur, vous devez libérer la même énergie, mais avec un signe opposé, à ΔHVapeur; c'est-à-dire son enthalpie de condensation ΔHCond. Ainsi, l'équilibre inverse vapeur-liquide est établi.
Fenêtres humides

La condensation peut être vue sur les fenêtres des maisons elles-mêmes. Dans un climat froid, la vapeur d'eau contenue à l'intérieur de la maison entre en collision avec la fenêtre qui, en raison de son matériau, a une température plus basse que les autres surfaces..
Là, il est plus facile pour les molécules de vapeur de s'agglutiner, créant une fine couche blanchâtre facilement amovible à la main. Au fur et à mesure que ces molécules dégagent de la chaleur (chauffant le verre et l'air), elles commencent à former des amas plus nombreux jusqu'à ce que les premières gouttes puissent se condenser (image du haut).
Lorsque les gouttes deviennent très grosses, elles glissent le long de la fenêtre et laissent une traînée d'eau.
- Solidification
La solidification est le changement d'état d'une substance de l'état liquide à l'état solide.

La solidification se produit à la suite du refroidissement; en d'autres termes, l'eau gèle. Pour geler, l'eau doit libérer la même quantité de chaleur que la glace absorbe pour fondre. Encore une fois, cette chaleur est appelée l'enthalpie de solidification ou de congélation, ΔHCong (-ΔHFus).
Au fur et à mesure que les molécules d'eau se refroidissent, elles perdent de l'énergie et leurs interactions intermoléculaires deviennent plus fortes et plus directionnelles. En conséquence, ils sont disposés grâce à leurs liaisons hydrogène et forment ce que l'on appelle des cristaux de glace. Le mécanisme par lequel les cristaux de glace se développent a un impact sur leur apparence: transparent ou blanc.

Si les cristaux de glace se développent très lentement, ils n'obstruent pas les impuretés, telles que les gaz qui se dissolvent dans l'eau à basse température. Ainsi, les bulles s'échappent et ne peuvent pas interagir avec la lumière; et par conséquent, vous avez une glace aussi transparente que celle d'une statue de glace extraordinaire (image du haut).
La même chose qui se produit avec la glace, cela peut arriver avec toute autre substance qui se solidifie par refroidissement. C'est peut-être le changement physique le plus complexe des conditions terrestres, car plusieurs polymorphes peuvent être obtenus.
- Sublimation
La sublimation est le changement d'état d'une substance de l'état solide à l'état gazeux.
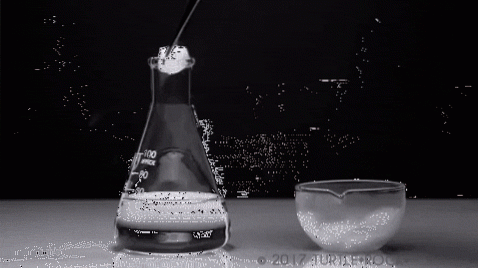
L'eau peut-elle être sublimée? Non, du moins pas dans des conditions normales (T = 25 ° C, P = 1 atm). Pour que la sublimation se produise, c'est-à-dire le changement d'état du solide au gaz, la pression de vapeur du solide doit être élevée.
De même, il est essentiel que leurs forces intermoléculaires ne soient pas très fortes, de préférence si elles consistent uniquement en des forces de dispersion.
L'exemple le plus emblématique est l'iode solide. C'est un solide cristallin aux teintes gris-violet, qui présente une pression de vapeur élevée. À tel point que, dans l'action de celui-ci, une vapeur violette se dégage, dont le volume et l'expansion deviennent perceptibles lorsqu'ils sont soumis à un chauffage..

Une expérience typique est montrée dans l'image ci-dessus où l'iode solide est évaporé dans un récipient en verre. Il est intéressant et frappant d'observer comment les vapeurs violettes se diffusent, et l'étudiant initié peut vérifier l'absence d'iode liquide.
C'est la caractéristique principale de la sublimation: il n'y a pas de présence de phase liquide. De même, il est endothermique, car le solide absorbe la chaleur pour augmenter sa pression de vapeur jusqu'à ce qu'elle soit égale à la pression externe..
- Déposition

Le dépôt est le changement d'état d'une substance de l'état gazeux à l'état solide.
Parallèlement à l'expérience de sublimation à l'iode, il y a celui de son dépôt. Le dépôt est le changement ou la transition inverse: la substance passe de l'état gazeux au solide sans formation de phase liquide.
Lorsque des vapeurs d'iode violettes entrent en contact avec une surface froide, elles libèrent de la chaleur pour la réchauffer, perdant de l'énergie et regroupant leurs molécules dans le solide gris-violet (image du haut). C'est alors un processus exothermique.
Le dépôt est largement utilisé pour la synthèse de matériaux où ils sont dopés avec des atomes métalliques par des techniques sophistiquées. Si la surface est très froide, l'échange thermique entre elle et les particules de vapeur est brusque, omettant le passage à travers la phase liquide respective..
La chaleur ou l'enthalpie de dépôt (et non dépôt) est l'inverse de la sublimation (ΔHSous= - ΔHD.E.P). En théorie, de nombreuses substances peuvent être sublimées, mais pour y parvenir, il est nécessaire de manipuler les pressions et les températures, en plus d'avoir leur diagramme P vs T à portée de main; dans lequel, ses phases possibles éloignées peuvent être visualisées.
Autres changements de statut
Bien qu'aucune mention n'en soit faite, il existe d'autres états de la matière. Parfois, ils se caractérisent par le fait d'avoir «un peu de chacun», et donc d'être une combinaison de ceux-ci. Pour les générer, les pressions et les températures doivent être manipulées à des magnitudes très positives (grandes) ou négatives (petites)..
Ainsi, par exemple, si les gaz sont chauffés de manière excessive, ils perdront leurs électrons et leurs noyaux chargés positivement dans cette marée négative constituera ce que l'on appelle le plasma. Il est synonyme de "gaz électrique", car il a une conductivité électrique élevée.
En revanche, lorsque les températures chutent trop bas, la matière peut se comporter de manière inattendue; c'est-à-dire qu'ils présentent des propriétés uniques autour du zéro absolu (0 K).
L'une de ces propriétés est la superfluidité et la supraconductivité; ainsi que la formation de condensats de Bose-Einstein, où tous les atomes se comportent comme un.
Certaines recherches pointent même vers la matière photonique. En eux, les particules de rayonnement électromagnétique, les photons, se regroupent pour former des molécules photoniques. Autrement dit, cela donnerait de la masse à des corps de lumière, théoriquement.
Les références
- Helmenstine, Anne Marie, Ph.D. (19 novembre 2018). Liste des changements de phase entre les états de la matière. Récupéré de: thinkco.com
- Wikipédia. (2019). État de la matière. Récupéré de: en.wikipedia.org
- Dorling Kindersley. (2007). Changement d'état. Récupéré de: factmonster.com
- Meyers Ami. (2019). Changement de phase: évaporation, condensation, congélation, fusion, sublimation et dépôt. Étude. Récupéré de: study.com
- Bagley M. (11 avril 2016). Matière: définition et les cinq états de la matière. Récupéré de: livescience.com
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.



Personne n'a encore commenté ce post.