
Formule de charge formelle, comment la calculer et exemples
La charge formelle (CF) est celui qui est attribué à un atome d'une molécule ou d'un ion, ce qui permet d'expliquer ses structures et ses propriétés chimiques en fonction de celui-ci. Ce concept implique la prise en compte du caractère maximum de covalence dans la liaison A-B; c'est-à-dire que la paire d'électrons est partagée également entre A et B.
Pour comprendre ce qui précède, l'image du bas montre deux atomes liés: l'un désigné par la lettre A et l'autre par la lettre B. Comme on peut le voir, dans l'intersection des cercles, une liaison est formée avec la paire ":". Dans cette molécule hétéronucléaire, si A et B ont des électronégativités égales, la paire ":" reste équidistante de A et de B.
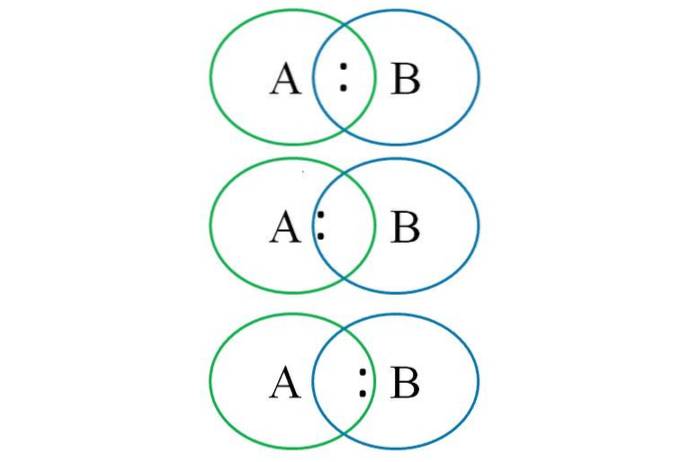
Cependant, comme deux atomes différents ne peuvent pas avoir des propriétés identiques, la paire «:» est attirée par celui qui est le plus électronégatif. Dans ce cas, si A est plus électronégatif que B, la paire ":" est plus proche de A que de B. Le contraire se produit lorsque B est plus électronégatif que A, se rapprochant maintenant de ":" vers B.
Ainsi, pour attribuer les charges formelles à la fois à A et à B, il est nécessaire de considérer le premier cas (celui au-dessus de l'image). Si la liaison purement covalente A-B était rompue, une rupture homolytique se produirait, générant les radicaux libres A · et · B.
Index des articles
- 1 Bénéfices qualitatifs de l'emploi de la charge formelle
- 2 Formule et comment la calculer
- 2.1 Variations du calcul en fonction de la structure
- 3 Exemples de calculs de charges formelles
- 3.1 BF4- (ion tétrafluoroborate)
- 3.2 BeH2 (hydrure de béryllium)
- 3,3 CO (monoxyde de carbone)
- 3.4 NH4 + (ion ammonium), NH3 et NH2- (ion amide)
- 4 Références
Avantages qualitatifs de l'emploi de la charge formelle
Les électrons ne sont pas fixes, comme dans l'exemple précédent, mais voyagent et se perdent à travers les atomes de la molécule ou de l'ion. S'il s'agit d'une molécule diatomique, on sait que le couple «:» doit être partagé ou errant entre les deux atomes; la même chose se produit dans une molécule de type A-B-C, mais avec une plus grande complexité.
Cependant, en étudiant un atome et en supposant une covalence de cent pour cent dans ses liaisons, il est plus facile d'établir s'il gagne ou perd des électrons dans le composé. Pour déterminer ce gain ou cette perte, votre ligne de base ou votre état libre doit être comparé à votre environnement électronique..
De cette façon, il est possible d'attribuer une charge positive (+) si l'atome perd un électron, ou une charge négative (-) quand, au contraire, il gagne un électron (les signes doivent être écrits à l'intérieur d'un cercle).
Ainsi, bien que les électrons ne puissent pas être localisés exactement, ces charges formelles (+) et (-) sur les structures sont conformes dans la plupart des cas aux propriétés chimiques attendues..
Autrement dit, la charge formelle d'un atome est étroitement liée à la géométrie moléculaire de son environnement et à sa réactivité au sein du composé..
Formule et comment la calculer
Les frais officiels sont-ils attribués de manière arbitraire? La réponse est non. Pour cela, le gain ou la perte d'électrons doit être calculé en supposant des liaisons purement covalentes, et ceci est obtenu grâce à la formule suivante:
CF = (numéro de groupe de l'atome) - (nombre de liaisons qu'il forme) - (nombre d'électrons non partagés)
Si l'atome a un CF avec une valeur de +1, il se voit attribuer une charge positive (+); alors que si vous avez un CF avec une valeur de -1, une charge négative (-) lui est attribuée.
Pour calculer correctement la FC, les étapes suivantes doivent être suivies:
- Localisez dans quel groupe l'atome se trouve dans le tableau périodique.
- Comptez le nombre de liaisons qu'il forme avec ses voisins: les doubles liaisons (=) valent deux et les triples liaisons valent trois (≡).
- Enfin, comptez le nombre d'électrons non partagés, qui peuvent être facilement observés avec les structures de Lewis.
Calcul des variations selon la structure
Compte tenu de la molécule linéaire A-B-C-D, les charges formelles de chaque atome peuvent varier si la structure, par exemple, s'écrit désormais: B-C-A-D, C-A-B-D, A-C-D-B, etc. En effet, il y a des atomes qui, en partageant plus d'électrons (formant plus de liaisons), acquièrent des CF positifs ou négatifs.
Alors, laquelle des trois structures moléculaires possibles correspond au composé ABCD? La réponse est: celle qui a généralement les valeurs CF les plus basses; de même, celui qui attribue des charges négatives (-) aux atomes les plus électronégatifs.
Si C et D sont plus électronégatifs que A et B, alors en partageant plus d'électrons, ils acquièrent par conséquent des charges positives formelles (vues à partir d'une règle mnémotechnique).
Ainsi, la structure la plus stable, et la plus énergétiquement favorisée, est C-A-B-D, puisque dans cette structure à la fois C et B ne forment qu'une seule liaison. Par contre, la structure A-B-C-D et celles qui ont C ou B formant deux liaisons (-C- ou -D-), sont plus instables.
Laquelle de toutes les structures est la plus instable? A-C-D-B, car non seulement C et D forment deux liaisons, mais aussi leurs charges négatives formelles (-) sont adjacentes l'une à l'autre, déstabilisant davantage la structure.
Exemples de calculs de charge formels
BF4- (ion tétrafluoroborate)
L'atome de bore est entouré de quatre atomes de fluor. Puisque B appartient au groupe IIIA (13), il manque d'électrons non partagés et forme quatre liaisons covalentes, son CF est (3-4-0 = -1). Par contre, pour F, élément du groupe VIIA (17), son CF est (7-6-1 = 0).
Pour déterminer la charge de l'ion ou de la molécule, il suffit d'ajouter le CF individuel des atomes qui le composent: (1 (-1) + 4 (0) = -1).
Cependant, le CF pour B n'a aucune signification réelle; c'est-à-dire que la densité électronique la plus élevée n'y réside pas. En réalité, cette densité électronique est distribuée vers les quatre atomes de F, élément beaucoup plus électronégatif que B.
BeHdeux (hydrure de béryllium)
L'atome de béryllium appartient au groupe IIA (2), forme deux liaisons et manque, là encore, d'électrons non partagés. Ainsi, les CF pour Be et H sont:
CFÊtre= 2-2-0 = 0
CFH= 1-1-0 = 0
Charge BeHdeux= 1 (0) + 2 (0) = 0
CO (monoxyde de carbone)
Sa structure de Lewis peut être représentée par: C≡O: (bien qu'elle ait d'autres structures de résonance). En répétant le calcul CF, cette fois pour C (du groupe IVA) et O (du groupe VIA), on a:
CFC= 4-3-2 = -1
CFOU ALORS= 6-3-2 = +1
Ceci est un exemple où les frais formels ne sont pas conformes à la nature des éléments. O est plus électronégatif que C et ne doit donc pas porter de signe positif.
Les autres structures (C = O et (+)CO(-)), bien qu'ils respectent l'assignation cohérente des charges, ils ne respectent pas la règle de l'octet (C a moins de huit électrons de valence).
NH4+ (ion ammonium), NH3 et NHdeux- (ion amide)
plus N de part d'électrons, plus son CF est positif (même l'ion ammonium, car il n'a pas d'énergie disponible pour former cinq liaisons).
En appliquant également les calculs de N dans l'ion ammonium, l'ammoniac et l'ion amide, nous avons alors:
CF = 5-4-0 = +1 (NH4+)
CF = 5-3-2 = 0 (NH3)
Et finalement:
CF = 5-2-4 = -1 (NHdeux-)
Autrement dit, dans le NHdeux- N a quatre électrons non partagés, et les partage tous quand il forme NH4+. Le CF pour le H est égal à 0 et donc votre calcul est sauvegardé.
Les références
- James. (2018). Une compétence clé: comment calculer les frais formels. Extrait le 23 mai 2018 de: masterorganicchemistry.com
- Dr Ian Hunt. Département de chimie, Université de Calgary. Charges formelles. Extrait le 23 mai 2018 de: chem.ucalgary.ca
- Charges formelles. [PDF]. Extrait le 23 mai 2018 de: chem.ucla.edu
- Jeff D. Cronk. Charge formelle. Extrait le 23 mai 2018 de: guweb2.gonzaga.edu
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE, p 268-270.
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition., P. 38). Mc Graw Hill.
- Monica Gonzalez. (10 août 2010). Charge formelle. Extrait le 23 mai 2018 de: quimica.laguia2000.com


Personne n'a encore commenté ce post.