
Structure, propriétés, utilisations et synthèse du salicylate de méthyle

le le salicylate de méthyle C'est une substance chimique, de nature organique, considérée comme le composé le plus toxique parmi les salicylates connus, malgré son aspect incolore et une odeur agréable avec une légère touche sucrée. Cette espèce est mieux connue sous le nom d'huile de gaulthérie.
Il est à l'état liquide dans des conditions standard de température et de pression (25 ° C et 1 atm), constituant un ester organique présent naturellement dans une grande variété de plantes. A partir de l'observation et de l'étude de sa production dans la nature, il a été possible de procéder à la synthèse du salicylate de méthyle.

Cette synthèse a été réalisée au moyen d'une réaction chimique entre l'ester d'acide salicylique et sa combinaison avec le méthanol. De cette façon, ce composé fait partie de la sauge, du vin blanc et des fruits tels que les prunes et les pommes, entre autres trouvés naturellement..
Synthétiquement, le salicylate de méthyle est utilisé dans la production d'agents aromatisants, ainsi que dans certains aliments et boissons..
Index des articles
- 1 Structure chimique
- 2 propriétés
- 3 utilisations
- 4 Synthèse
- 5 Références
Structure chimique
La structure chimique du salicylate de méthyle est composée de deux groupes fonctionnels principaux (un ester et un phénol qui y sont attachés), comme le montre l'image ci-dessus.
On observe qu'il est constitué d'un cycle benzénique (qui représente une influence directe sur la réactivité et la stabilité du composé), provenant de l'acide salicylique dont il est issu..
Pour les nommer séparément, on peut dire qu'un groupe hydroxyle et un ester méthylique sont fixés en position ortho (1,2) sur le cycle précité..
Ensuite, lorsque le groupe OH est attaché au cycle benzénique, un phénol se forme, mais le groupe qui a la «hiérarchie» la plus élevée dans cette molécule est l'ester, donnant à ce composé une structure particulière et, par conséquent, des caractéristiques tout à fait spécifiques..
De cette manière, son nom chimique est présenté comme le 2-hydroxybenzoate de méthyle, accordé par l'IUPAC bien qu'il soit moins fréquemment utilisé en se référant à ce composé..
Propriétés
- C'est une espèce chimique qui appartient au groupe des salicylates, qui sont des produits d'origine naturelle issus du métabolisme de certains organismes végétaux..
- Les propriétés thérapeutiques des salicylates dans les traitements médicaux sont connues.
- Ce composé est présent dans certaines boissons comme le vin blanc, le thé, la sauge et certains fruits comme la papaye ou la cerise..
- On le trouve naturellement dans les feuilles d'un grand nombre de plantes, notamment dans certaines familles.
- Il appartient au groupe des esters organiques synthétisables en laboratoire.
- Il est obtenu à l'état liquide, dont la densité est d'environ 1 174 g / ml dans des conditions standard de pression et de température (1 atm et 25 ° C)..
- Il forme une phase liquide incolore, jaunâtre ou rougeâtre, considérée comme soluble dans l'eau (qui est un solvant inorganique) et dans d'autres solvants organiques.
- Son point d'ébullition est d'environ 222 ° C, manifestant sa décomposition thermique autour de 340 à 350 ° C.
- Il a de multiples applications, allant de l'agent aromatisant dans l'industrie des bonbons aux analgésiques et à d'autres produits de l'industrie pharmaceutique..
- Sa formule moléculaire est représentée par C8H8OU ALORS3 et a une masse molaire de 152,15 g / mol.
Applications
En raison de ses caractéristiques structurelles, étant un ester méthylique de l'acide salicylique, le salicylate de méthyle a un grand nombre d'utilisations dans différents domaines.
L'une des principales utilisations (et la plus connue) de cette substance est comme agent aromatisant dans différents produits: de l'industrie cosmétique comme parfum à l'industrie alimentaire comme arôme dans les bonbons (chewing-gum, bonbons, glaces, entre autres) ).
Il est également utilisé dans l'industrie cosmétique comme agent chauffant et pour le massage musculaire dans les applications sportives. Dans ce dernier cas, il agit comme un rubéfiant; c'est-à-dire qu'il provoque une rougeur superficielle de la peau et des muqueuses au contact de ces.
De la même manière, il est utilisé dans une crème à usage topique, en raison de ses propriétés analgésiques et anti-inflammatoires dans les traitements des affections rhumatismales..
Une autre de ses applications comprend son utilisation liquide dans les séances d'aromathérapie, en raison de ses caractéristiques d'huile essentielle..
Outre son utilisation comme agent de protection contre les rayons ultraviolets dans les écrans solaires, ses propriétés contre la lumière sont étudiées pour des applications technologiques, telles que la production de rayons laser ou la création d'espèces sensibles au stockage d'informations au sein des molécules..
La synthèse
Tout d'abord, il convient de mentionner que le salicylate de méthyle peut être obtenu naturellement à partir de la distillation des branches de certaines plantes, comme la gaulthérie (Gaultheria procumbens) ou bouleau doux (Betula lente).
Cette substance a été extraite et isolée pour la première fois en 1843 grâce au scientifique d'origine française nommé Auguste Cahours; à partir de la gaulthérie, il est actuellement obtenu par synthèse en laboratoire et même commercialement.
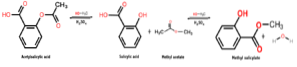
La réaction qui se produit pour obtenir ce composé chimique est un processus appelé estérification, dans lequel un ester est obtenu par la réaction entre un alcool et un acide carboxylique. Dans ce cas, il se produit entre le méthanol et l'acide salicylique, comme indiqué ci-dessous:
CH3OH + C7H6OU ALORS3 → C8H8OU ALORS3 + HdeuxOU ALORS
Il est à noter que la partie de la molécule d'acide salicylique qui est estérifiée avec le groupe hydroxyle (OH) de l'alcool est le groupe carboxyle (COOH).
Ensuite, ce qui se passe entre ces deux espèces chimiques est une réaction de condensation, car la molécule d'eau présente entre les réactifs est éliminée tandis que les autres espèces réactives sont condensées afin d'obtenir du salicylate de méthyle..
L'image suivante montre la synthèse du salicylate de méthyle à partir de l'acide salicylique, où deux réactions successives sont montrées.
Les références
- Wikipédia. (s.f.). Le salicylate de méthyle. Récupéré de en.wikipedia.org
- Britannica, E. (s.f.). Le salicylate de méthyle. Récupéré de britannica.com
- Conseil de l'Europe. Comité d'experts sur les produits cosmétiques. (2008). Ingrédients actifs utilisés dans les cosmétiques: enquête de sécurité. Récupéré de books.google.co.ve
- Dasgupta, A., et Wahed, A. (2013). Chimie clinique, immunologie et contrôle de la qualité en laboratoire. Obtenu sur books.google.co.ve
- PubChem. (s.f.) Salicylate de méthyle. Récupéré de pubchem.ncbi.nlm.nih.gov



Personne n'a encore commenté ce post.