
Histoires, déclarations et exemples sur le droit de Ritchter-Wenzel

La Loi de Ritchter-Wenzel ou des proportions réciproques est celle qui établit que les proportions massiques entre deux composés permettent de déterminer celle d'un troisième composé. C'est une des lois de la stoechiométrie, avec la loi de Lavoisier (loi de conservation de la masse); Loi de Proust (loi des proportions définies); et loi de Dalton (loi des proportions multiples).
Ritcher a énoncé sa loi en 1792 dans un livre définissant les principes fondamentaux de la stoechiométrie, sur la base des travaux de recherche de Carl F. Wenzel, qui en 1777 a publié le premier tableau d'équivalence pour les acides et les bases..
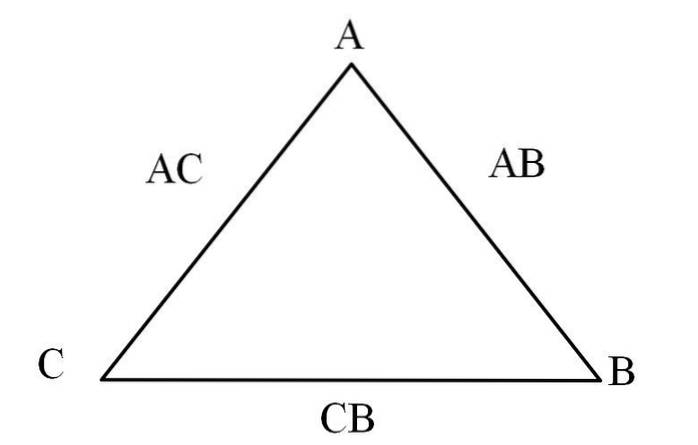
Un moyen simple de le visualiser est à travers un «triangle de réciprocité» (image ci-dessus). Si vous connaissez les masses de A, C et B qui se mélangent pour former les composés AC et AB, vous pouvez déterminer la quantité de C et B qui se mélangent ou réagissent pour former le composé CB.
Dans les composés AC et AB, l'élément A est présent dans les deux, donc en divisant leurs proportions massiques, vous découvrirez combien C réagit avec B.
Index des articles
- 1 Histoire et généralités de la loi des proportions réciproques
- 2 Déclarations et conséquences
- 3 exemples
- 3.1 Chlorure de calcium
- 3.2 Oxydes de soufre
- 3.3 Sulfure et oxyde de fer
- 4 Références
Histoire et généralités de la loi des proportions réciproques
Richter a constaté que le rapport pondéral des composés consommés dans une réaction chimique est toujours le même.
À cet égard, Ritcher a constaté que 615 parties en poids de magnésie (MgO) sont nécessaires, par exemple, pour neutraliser 1000 parties en poids d'acide sulfurique..
Entre 1792 et 1794, Ritcher a publié un résumé en trois volumes contenant son travail sur la loi des proportions définies. L'abrégé traitait de la stoechiométrie, la définissant comme l'art des mesures chimiques..
Notant, en outre, que la stoechiométrie traite des lois selon lesquelles les substances s'unissent pour former des composés. Cependant, le travail de recherche de Richter a été critiqué pour le traitement mathématique qu'il a utilisé, et il a même été souligné qu'il avait ajusté ses résultats..
En 1802, Ernst Gottfried Fischer a publié le premier tableau des équivalents chimiques, qui utilisait de l'acide sulfurique avec le chiffre de 1000; similaire à la valeur trouvée par Richter, pour la neutralisation de l'acide sulfurique par la magnésie.
Cependant, il a été noté que Richter a construit un tableau de poids de combinaison qui indiquait la vitesse à laquelle un certain nombre de composés ont réagi. Par exemple, il est indiqué que 859 parties de NaOH neutralisent 712 parties de HNO3.
Déclarations et conséquences
L'énoncé de la loi de Richter-Wenzel est le suivant: les masses de deux éléments différents qui sont combinés avec la même quantité d'un troisième élément, gardent le même rapport que les masses de ces éléments lorsqu'ils sont combinés entre eux.
Cette loi permettait d'établir le poids équivalent, ou équivalent poids-gramme, comme la quantité d'un élément ou d'un composé qui réagira avec une quantité fixe d'une substance de référence.
Richter a appelé les poids combinés par rapport aux poids des éléments qui se combinaient avec chaque gramme d'hydrogène. Les poids de combinaison relatifs de Richter correspondent à ce que l'on appelle actuellement le poids équivalent des éléments ou des composés.
Conformément à l'approche précédente, la loi de Richter-Wenzel peut être énoncée comme suit:
Les poids de combinaison de différents éléments qui sont combinés avec un poids donné d'un élément donné sont les poids de combinaison relatifs de ces éléments lorsqu'ils sont combinés les uns avec les autres, ou des multiples ou sous-multiples de ces relations de quantité.
Exemples
Chlorure de calcium
Dans l'oxyde de calcium (CaO), 40 g de calcium se combinent avec 16 g d'oxygène (O). Pendant ce temps, dans l'oxyde hypochloreux (CldeuxO), 71 g de chlore sont combinés avec 16 g d'oxygène. Quel composé ferait le calcium s'il était combiné avec du chlore?
En utilisant le triangle de réciprocité, l'oxygène est l'élément commun aux deux composés. Les proportions massiques des deux composés oxygénés sont d'abord déterminées:
40g Ca / 16 gO = 5g Ca / 2g O
71g Cl / 16g O
Et maintenant en divisant les deux proportions massiques de CaO et CldeuxOu nous aurons:
(5g Ca / 2g O) / (71g Cl / 16g O) = 80g Ca / 142g Cl = 40g Ca / 71g Cl
A noter que la loi des proportions massiques est remplie: 40 g de calcium réagissent avec 71 g de chlore.
Oxydes de soufre
L'oxygène et le soufre réagissent avec le cuivre pour donner respectivement de l'oxyde de cuivre (CuO) et du sulfure de cuivre (CuS). Combien de soufre réagirait avec l'oxygène?
Dans l'oxyde de cuivre, 63,5 g de cuivre sont combinés avec 16 g d'oxygène. Dans le sulfure de cuivre, 63,5 g de cuivre se lient à 32 g de soufre. En divisant les proportions de masse que nous avons:
(63,5 g Cu / 16 g O) / (63,5 g Cu / 32 g S) = 2032 g S / 1016 g O = 2 g S / 1 g O
Le rapport de masse 2: 1 est un multiple de 4 (63,5 / 16), ce qui montre que la loi de Richter est vraie. Avec cette proportion, SO, on obtient du monoxyde de soufre (32 g de soufre réagissent avec 16 g d'oxygène).
Si vous divisez ce rapport par deux, vous obtiendrez 1: 1. Encore une fois, c'est maintenant un multiple de 4 ou 2, et il s'agit donc du SOdeux, dioxyde de soufre (32g de soufre réagit avec 32g d'oxygène).
Sulfure et oxyde de fer
Le sulfure de fer (FeS), dans lequel 32 g de soufre sont combinés avec 56 g de fer, est mis à réagir avec de l'oxyde ferreux (FeO), dans lequel 16 g d'oxygène sont combinés avec 56 g de fer. Cet article sert de référence.
Dans les composés réactifs FeS et FeO, le soufre (S) et l'oxygène (O) par rapport au fer (Fe) se trouvent dans le rapport 2: 1. Dans l'oxyde sulfureux (SO), 32 g de soufre sont combinés avec 16 g d'oxygène, de sorte que le soufre et l'oxygène sont dans le rapport 2: 1.
Cela indique que la loi des proportions réciproques ou la loi de Richter est remplie.
Le rapport trouvé entre le soufre et l'oxygène dans l'oxyde de soufre (2: 1), pourrait être utilisé, par exemple, pour calculer combien d'oxygène réagit avec 15 g de soufre.
g d'oxygène = (15g de S) ∙ (1g d'O / 2g de S) = 7,5g
Les références
- Foist L. (2019). Loi de la proportion réciproque: définition et exemples. Étude. Récupéré de: study.com
- Tâches cybernétiques. (2016, 9 février). Loi des proportions réciproques ou Richter-Wenzel. Récupéré de: cibertareas.infol
- Wikipédia. (2018). Loi des proportions réciproques. Récupéré de: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter et la loi des proportions réciproques.-II, Annals of Science, 9: 4, 289-314, DOI: 10.1080 / 00033795300200233
- Shrestha B. (18 juin 2015). Loi des proportions réciproques. Libretexts de chimie. Récupéré de: chem.libretexts.org
- Redéfinir les connaissances. (29 juillet 2017). Loi des proportions réciproques. Récupéré de: hemantmore.org.in



Personne n'a encore commenté ce post.