
Propriétés, utilisations, structures, risques du cyanure de potassium (KCN),
le cyanure de potassium est un composé inorganique formé par un ion potassium K+ et un ion cyanure CN-. Sa formule chimique est KCN. C'est un solide cristallin blanc, extrêmement toxique.
Le KCN est très soluble dans l'eau et lorsqu'il est dissous, il s'hydrolyse en formant de l'acide cyanhydrique ou du cyanure d'hydrogène HCN, qui est également très toxique. Le cyanure de potassium peut former des sels composés avec l'or et l'argent, c'est pourquoi il était autrefois utilisé pour extraire ces métaux précieux de certains minéraux..

Le KCN est utilisé pour revêtir des métaux bon marché d'or et d'argent par un processus électrochimique, c'est-à-dire une méthode dans laquelle un courant électrique est passé à travers une solution contenant un sel composé du métal précieux, du cyanure et du potassium..
Le cyanure de potassium, car il contient du cyanure, doit être manipulé avec le plus grand soin, avec des outils appropriés. Il ne doit jamais être jeté dans l'environnement, car il est également très toxique pour la plupart des animaux et des plantes..
Cependant, des méthodes utilisant des algues communes pour éliminer le cyanure de potassium des eaux contaminées par de faibles concentrations de cyanure de potassium sont à l'étude..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Densité
- 3.6 Solubilité
- PH 3,7
- 3.8 Constante d'hydrolyse
- 3.9 Propriétés chimiques
- 3.10 Autres propriétés
- 4 Obtention
- 5 Utilisation dans la galvanoplastie des métaux
- 5.1 Argent
- 5.2 Or
- 5.3 Autres utilisations
- 6 risques
- 7 Mécanisme d'action
- 7.1 Risques supplémentaires
- 8 Études récentes
- 9 Références
Structure
KCN est un composé ionique formé par un cation potassium K+ et un anion cyanure CN-. En cela, l'atome de carbone est lié à l'atome d'azote par une triple liaison covalente..

Dans le cyanure de potassium solide, l'anion CN- Il peut tourner librement pour qu'il se comporte comme un anion sphérique, en conséquence le cristal KCN a une structure cubique similaire à celle du chlorure de potassium KCl.
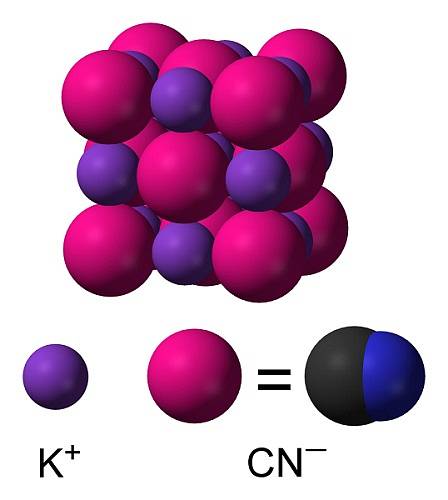
Nomenclature
- Cyanure de potassium
- Cyanure de potassium
- Cyanopotassium
Propriétés
État physique
Solide cristallin blanc. Cristaux cubiques.
Poids moléculaire
65,116 g / mol.
Point de fusion
634,5 ° C
Point d'ébullition
1625 ° C.
Densité
1,55 g / cm3 à 20 ° C.
Solubilité
Très soluble dans l'eau: 716 g / L à 25 ° C et 100 g / 100 mL d'eau à 80 ° C. Légèrement soluble dans le méthanol: 4,91 g / 100 g de méthanol à 19,5 ° C. Très légèrement soluble dans l'éthanol: 0,57 g / 100 g d'éthanol à 19,5 ° C.
pH
Une solution aqueuse de 6,5 g de KCN dans 1 L d'eau a un pH de 11,0.
Constante d'hydrolyse
Le KCN est très soluble dans l'eau. Lorsqu'il se dissout, l'ion cyanure CN est libre- qui prend un proton H+ d'eau pour former de l'acide cyanhydrique HCN et libérer un ion OH-:
CN- + HdeuxO → HCN + OH-
La constante d'hydrolyse indique la tendance avec laquelle ladite réaction est effectuée.
Kh = 2,54 x 10-5
Les solutions aqueuses de KCN libèrent du cyanure d'hydrogène HCN dans l'environnement lorsqu'elles sont chauffées à plus de 80 ° C.
Propriétés chimiques
Il n'est pas inflammable, mais lorsque le KCN solide est chauffé jusqu'à la décomposition, il émet des gaz très toxiques de cyanure d'hydrogène HCN, oxydes d'azote NOX, oxyde de potassium KdeuxO et monoxyde de carbone CO.
KCN réagit avec les sels d'or pour former de l'aurocyanure de potassium KAu (CN)deux et oreillette potassique KAu (CN)4. Ce sont des sels complexes incolores. Avec le métal argenté Ag, KCN forme le potassium argentocyanure KAg (CN)deux.
L'ion cyanure du KCN réagit avec certains composés organiques contenant des halogènes (comme le chlore ou le brome) et prend leur place. Par exemple, il réagit avec l'acide bromoacétique pour donner de l'acide cyanoacétique..
Autres propriétés
Il est hygroscopique, absorbe l'humidité de l'environnement.
Il a une légère odeur d'amande amère, mais cela n'est pas détecté par tout le monde.
Obtention
KCN est préparé en faisant réagir l'hydroxyde de potassium KOH en solution aqueuse avec du cyanure d'hydrogène HCN. Il est également obtenu par chauffage du ferrocyanure de potassium K4Foi (CN)6:
K4Foi (CN)6 → 4 KCN + 2 C + Ndeux↑ + Foi
Utilisation dans la galvanoplastie des métaux
Il est utilisé dans le processus de revêtement des métaux de faible valeur avec de l'or et de l'argent. C'est un processus électrolytique, c'est-à-dire que l'électricité passe à travers une solution aqueuse avec des sels appropriés.
Argent
L'argentocyanure de potassium KAg (CN) est utilisédeux pour le revêtement d'argent (Ag) des métaux moins chers.
Ceux-ci sont placés dans une solution aqueuse d'argentocyanure de potassium KAg (CN)deux, où l'anode ou le pôle positif est une barre d'argent pur (Ag) et la cathode ou le pôle négatif est le métal bon marché que vous voulez enduire d'argent.
Lorsqu'un courant électrique traverse la solution, l'argent se dépose sur l'autre métal. Lorsque des sels de cyanure sont utilisés, la couche d'argent est déposée d'une manière plus fine, plus compacte et adhérente que dans les solutions d'autres composés..

Or
De même dans le cas de l'or (Au), de l'aurocyanure de potassium KAu (CN)deux et oreillette potassique KAu (CN)4 sont utilisés pour dorer électrolytiquement d'autres métaux.

Autres utilisations
Voici quelques autres utilisations du cyanure de potassium.
- Pour le procédé industriel de durcissement de l'acier par nitruration (ajout d'azote).
- Pour le nettoyage du métal.
- Dans les processus d'impression et de photographie.
- Autrefois, il était utilisé pour l'extraction de l'or et de l'argent des minéraux qui les contiennent, mais plus tard, il a été remplacé par le cyanure de sodium NaCN qui est moins cher, bien que tout aussi toxique.
- En tant qu'insecticide pour la pulvérisation d'arbres, de navires, de wagons et d'entrepôts.
- En tant que réactif en chimie analytique, c'est-à-dire pour faire des analyses chimiques.
- Pour préparer d'autres composés chimiques, tels que des colorants et des colorants.

Des risques
Le KCN est un composé très toxique pour les animaux et la plupart des plantes et micro-organismes. Il est classé comme super toxique. Il est mortel même en très petites quantités.
Son effet nocif peut se produire par inhalation, par contact avec la peau ou les yeux ou par ingestion. Inhibe de nombreux processus métaboliques, en particulier les protéines sanguines impliquées dans le transport de l'oxygène comme l'hémoglobine.
Elle affecte les organes ou systèmes les plus sensibles à la privation d'oxygène, tels que le système nerveux central (cerveau), le système cardiovasculaire (cœur et vaisseaux sanguins) et les poumons.

Mécanisme d'action
KCN interfère avec la capacité du corps à utiliser l'oxygène.
L'ion cyanure CN- KCN a une haute affinité pour l'ion ferrique Fe3+, ce qui signifie que lorsque le cyanure est absorbé, il réagit rapidement avec Fe3+ de sang et de tissus.
De cette manière, il empêche les cellules de respirer, qui entrent dans un état de manque d'oxygène, car bien qu'elles essaient de respirer, elles ne peuvent pas l'utiliser..
Il y a ensuite un état transitoire d'hyperapnée (suspension de la respiration) et de maux de tête, et enfin la mort par arrêt respiratoire..
Risques supplémentaires
Lorsqu'il est chauffé, il produit des gaz très toxiques tels que HCN, oxydes d'azote NOX, oxyde de potassium KdeuxO et monoxyde de carbone CO.
Lorsqu'il entre en contact avec l'humidité, il libère du HCN qui est hautement inflammable et très toxique..
Le KCN est également très toxique pour les organismes aquatiques. Il ne doit jamais être jeté dans l'environnement, car la contamination des eaux où les animaux boivent et les poissons habitent peut se produire.
Cependant, il existe des bactéries qui produisent du cyanure comme Chromobacterium violaceum et certaines espèces de Pseudomonas.
Des études récentes
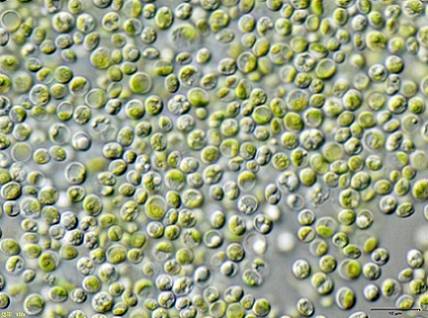
Certains chercheurs ont découvert que les algues vertes Chlorella vulgaris peut être utilisé pour traiter l'eau contaminée par le cyanure de potassium KCN à de faibles concentrations.
Les algues ont pu éliminer efficacement le KCN, car celui-ci en faible quantité a stimulé la croissance des algues car il a activé un mécanisme interne pour résister à la toxicité du KCN.
Cela signifie que l'algue Chlorella vulgaris a le potentiel d'éliminer le cyanure et qu'une méthode efficace pour le traitement biologique de la contamination par le cyanure pourrait être conçue avec ce.
Les références
- NOUS. Bibliothèque nationale de médecine. (2019). Cyanure de potassium. Centre national d'information sur la biotechnologie. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Coppock et R.W. (2009). Menaces pour la faune par les agents de guerre chimique. In Handbook of Toxicology of Chemical Warfare Agents. Récupéré de sciencedirect.com.
- Liu, Q. (2017). Évaluation de l'élimination du cyanure de potassium et de sa toxicité chez les algues vertes (Chlorella vulgaris). Bull Environ Contam Toxicol. 2018; 100 (2): 228-233. Récupéré de ncbi.nlm.nih.gov.
- L'Institut national pour la sécurité et la santé au travail (NIOSH). (2011). Cyanure de potassium: agent systémique. Récupéré de cdc.gov.
- Alvarado, L.J. et coll. (2014). Découverte, structure et fonction du Riboswitch. Synthèse d'Uracil. Dans Methods in Enzymology. Récupéré de sciencedirect.com.



Personne n'a encore commenté ce post.