
Structure, propriétés, synthèse et utilisations du cyclohexène
le cyclohexène est un alcène ou une oléfine cyclique dont la formule moléculaire est C6Hdix. Il se compose d'un liquide incolore, insoluble dans l'eau et miscible avec de nombreux solvants organiques. Il se caractérise par être inflammable et dans la nature, il se trouve généralement dans le goudron de houille.
Le cyclohexène est synthétisé par hydrogénation partielle du benzène et par déshydratation de l'alcool cyclohexanol; c'est-à-dire une forme plus oxydée. Comme les autres cycloalcènes, il subit des réactions d'addition électrophile et radicalaire; par exemple, la réaction d'halogénation.

Cet alcène cyclique (image du haut) forme des mélanges azéotropiques (non séparables par distillation), avec des alcools inférieurs et de l'acide acétique. Il n'est pas très stable en stockage prolongé, car il se décompose sous l'action de la lumière du soleil et des rayons ultraviolets.
Le cyclohexène est utilisé comme solvant, et a donc de nombreuses applications, telles que: stabilisant d'essence à indice d'octane élevé et pour l'extraction d'huiles.
Mais le plus important est que le cyclohexène sert d'intermédiaire et de matière première pour obtenir de nombreux composés très utiles, notamment: cyclohexanone, acide adipique, acide maléique, cyclohexane, butadiène, acide cyclohexylcarboxylique, etc..
Index des articles
- 1 Structure du cyclohexène
- 1.1 Interactions intermoléculaires
- 2 propriétés
- 2.1 Noms chimiques
- 2.2 Poids moléculaire
- 2.3 Apparence physique
- 2.4 Odeur
- 2.5 Point d'ébullition
- 2.6 Point de fusion
- 2.7 Point d'éclair
- 2.8 Solubilité dans l'eau
- 2.9 Solubilité dans les solvants organiques
- 2.10 Densité
- 2.11 Densité de vapeur
- 2.12 Pression de vapeur
- 2.13 Auto-allumage
- 2.14 Décomposition
- 2.15 Viscosité
- 2.16 Chaleur de combustion
- 2.17 Chaleur de vaporisation
- 2.18 Tension superficielle
- 2.19 Polymérisation
- 2.20 Seuil olfactif
- 2.21 Indice de réfraction
- 2,22 pH
- 2.23 Stabilité
- 2.24 Réactions
- 3 Synthèse
- 4 utilisations
- 5 risques
- 6 Références
Structure du cyclohexène
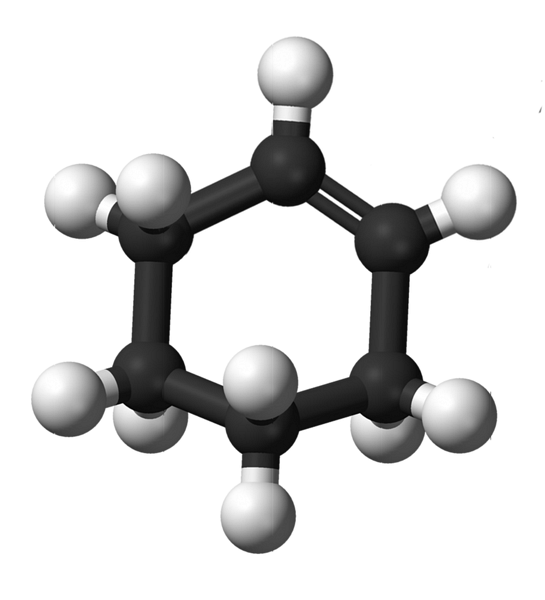
L'image du haut montre la structure du cyclohexène avec un modèle de sphères et de barres. Notez le cycle à six carbones et la double liaison, deux insaturations du composé. De ce point de vue, il apparaît que la bague est plate; mais ce n'est pas du tout.
Pour commencer, les carbones de la double liaison ont une hybridation spdeux, ce qui leur donne une géométrie plane trigonale. Par conséquent, ces deux carbones, et ceux qui leur sont adjacents, sont dans le même plan; tandis que les deux carbones à l'extrémité opposée (à la double liaison), sont au-dessus et au-dessous dudit plan.
L'image ci-dessous illustre parfaitement ce qui vient d'être expliqué.

Notez que la bande noire est composée de quatre carbones: les deux de la double liaison, et les autres adjacents à eux. La perspective exposée est celle qui serait obtenue si un spectateur plaçait son œil directement devant la double liaison. On voit alors qu'un carbone est au-dessus et au-dessous de ce plan.
La molécule de cyclohexène n'étant pas statique, les deux carbones s'échangeront: l'un descendra tandis que l'autre montera au-dessus du plan. Donc, vous vous attendriez à ce que cette molécule se comporte.
Interactions intermoléculaires
Le cyclohexène est un hydrocarbure et, par conséquent, ses interactions intermoléculaires sont basées sur les forces de dispersion de Londres.
En effet, la molécule est apolaire, sans moment dipolaire permanent, et son poids moléculaire est le facteur qui contribue le plus à la maintenir cohésive dans le liquide..
De même, la double liaison augmente le degré d'interaction, car elle ne peut pas se déplacer avec la même flexibilité que celle des autres carbones, ce qui favorise l'interaction entre molécules voisines. C'est pour cette raison que le cyclohexène a un point d'ébullition légèrement plus élevé (83 ° C) que celui du cyclohexane (81 ° C)..
Propriétés
Noms chimiques
Cyclohexène, tétrahydrobenzène.
Poids moléculaire
82,146 g / mol.
Aspect physique
Liquide incolore.
Odeur
Odeur douce.
Point d'ébullition
83 ºC à 760 mmHg.
Point de fusion
-103,5 ºC.
point d'allumage
-7 ºC (tasse fermée).
Solubilité dans l'eau
Pratiquement insoluble (213 mg / L).
Solubilité dans les solvants organiques
Miscible avec l'éthanol, le benzène, le tétrachlorure de carbone, l'éther de pétrole et l'acétone. On s'attend à ce qu'il soit capable de dissoudre des composés apolaires, tels que certains des allotropes du carbone..
Densité
0,810 g / cm3 à 20ºC.
Densité de vapeur
2,8 (par rapport à l'air pris égal à 1).
La pression de vapeur
89 mmHg à 25 ° C.
Auto-allumage
244 ºC.
Décomposition
Il se décompose en présence de sels d'uranium, sous l'action du soleil et des rayons ultraviolets.
Viscosité
0,625 mPascal à 25 ºC.
Chaleur de combustion
3751,7 kJ / mol à 25 ºC.
Chaleur de vaporisation
30,46 kJ / mol à 25 ºC.
Tension superficielle
26,26 mN / m.
Polymérisation
Peut polymériser sous certaines conditions.
Seuil d'odeur
0,6 mg / m3.
Indice de réfraction
1.4465 à 20 ºC.
pH
7-8 à 20ºC.
Stabilité
Le cyclohexène n'est pas très stable pendant le stockage à long terme. L'exposition à la lumière et à l'air peut conduire à la production de peroxydes. Il est également incompatible avec les agents oxydants puissants..
Réactions
-Les cycloalcènes subissent principalement des réactions d'addition, à la fois électrophiles et avec des radicaux libres.
-Réagit avec le brome pour former du 1,2-dibromocyclohexane.
-Il s'oxyde rapidement en présence de permanganate de potassium (KMnO4).
-Il est capable de produire un époxyde (oxyde de cyclohexène) en présence d'acide peroxybenzoïque.
La synthèse
Le cyclohexène est produit par catalyse acide du cyclohexanol:
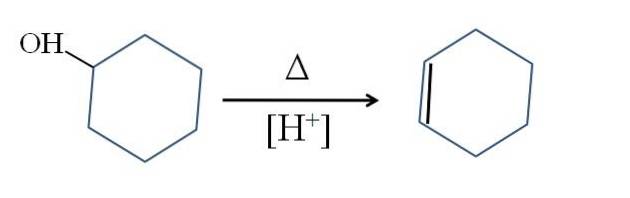
Le symbole Δ représente la chaleur nécessaire pour favoriser la sortie du groupement OH sous forme de molécule d'eau en milieu acide (-OHdeux+).
Le cyclohexène est également produit par hydrogénation partielle du benzène; c'est-à-dire que deux de ses doubles liaisons ajoutent une molécule d'hydrogène:
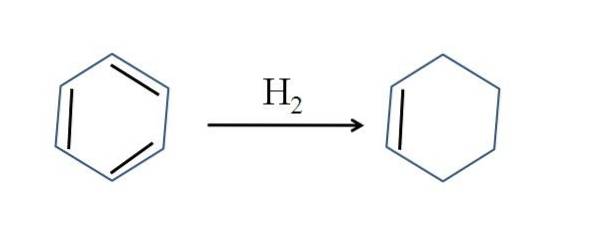
Bien que la réaction semble simple, elle nécessite de fortes pressions de Hdeux et catalyseurs.
Applications
-Il a une utilité comme solvant organique. De plus, c'est une matière première pour la production d'acide adipique, d'aldéhyde adipique, d'acide maléique, de cyclohexane et d'acide cyclohexylcarboxylique..
-Il est utilisé dans la production de chlorure de cyclohexane, un composé utilisé comme intermédiaire dans la fabrication de produits pharmaceutiques et d'additif en caoutchouc.
-Le cyclohexène est également utilisé dans la synthèse de la cyclohexanone, une matière première pour la production de médicaments, de pesticides, de parfums et de colorants..
-Le cyclohexène est impliqué dans la synthèse de l'aminocyclohexanol, un composé utilisé comme tensioactif et émulsifiant.
-De plus, le cyclohexène peut être utilisé pour la préparation en laboratoire du butadiène. Ce dernier composé est utilisé dans la fabrication de caoutchouc synthétique, dans la fabrication de pneus d'automobile, et est également utilisé dans la fabrication de plastiques acryliques..
-Le cyclohexène est une matière première pour la synthèse de la lysine, du phénol, de la résine polycyclooléfine et des additifs de caoutchouc.
-Il est utilisé comme stabilisant pour l'essence à indice d'octane élevé.
-Intervient dans la synthèse de revêtements imperméables, de films résistants aux fissures et de liants de collage pour revêtements.
Des risques
Le cyclohexène n'est pas un composé très toxique, mais il peut provoquer une rougeur de la peau et des yeux au contact. L'inhalation peut provoquer de la toux et de la somnolence. De plus, son ingestion peut provoquer somnolence, essoufflement et nausées..
Le cyclohexène est mal absorbé par le tractus gastro-intestinal, par conséquent, des effets systémiques graves ne sont pas attendus en cas d'ingestion. La complication maximale est son aspiration par le système respiratoire, ce qui peut provoquer une pneumonie chimique.
Les références
- Joseph F. Chiang et Simon Harvey Bauer. (1968). Structure moléculaire du cyclohexène. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cyclohexène: dangers, synthèse et structure. Étude. Récupéré de: study.com
- Morrison, R. T. et Boyd, R. N. (1987). Chimie organique. (5ta Édition.). Éditorial Addison-Wesley Iberoamericana.
- PubChem. (2019). Cyclohexène. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Livre chimique. (2019). Cyclohexène. Récupéré de: Chemicalbook.com
- Réseau de données toxicologiques. (2017). Cyclohexène. Toxnet. Récupéré de: toxnet.nlm.nih.gov
- Chemoxy. (s.f.). La formule développée du cyclohexène est. Récupéré de: chemoxy.com


Personne n'a encore commenté ce post.