
Histoire de l'acide acétique, structure, propriétés, utilisations
le acide acétique ou l'acide éthanoïque est un liquide organique incolore dont la formule chimique est CH3COOH. Une fois dissous dans l'eau, on obtient un mélange bien connu appelé vinaigre, qui est utilisé depuis longtemps comme additif dans les aliments. Le vinaigre est une solution aqueuse d'acide acétique avec une concentration d'environ 5%.
Comme son nom l'indique, c'est un composé acide, et donc le vinaigre a des pH inférieurs à 7. En présence de son sel acétate, il constitue un système tampon efficace pour réguler le pH entre 2,76 et 6,76; c'est-à-dire qu'il maintient le pH dans cette plage avec des ajouts modérés d'une base ou d'un acide.

Sa formule suffit à se rendre compte qu'il est formé par l'union d'un groupe méthyle (CH3) et un groupe carboxyle (COOH). Après l'acide formique, HCOOH, est l'un des acides organiques les plus simples; qui représente également le point final de nombreux processus de fermentation.
Ainsi, l'acide acétique peut être produit par fermentation bactérienne aérobie et anaérobie, et par synthèse chimique, le processus de carbonylation du méthanol étant le mécanisme principal de sa production..
En plus de son utilisation quotidienne comme vinaigrette, elle représente dans l'industrie la matière première pour la production d'acétate de cellulose, un polymère utilisé pour fabriquer des films photographiques. De plus, l'acide acétique est utilisé dans la synthèse de l'acétate de polyvinyle, utilisé pour fabriquer une colle pour le bois..
Lorsque le vinaigre est devenu très concentré, il n'est plus appelé comme tel et s'appelle acide acétique glacial. À ces concentrations, même s'il s'agit d'un acide faible, il est très corrosif et peut provoquer une irritation cutanée et respiratoire par simple respiration superficielle. L'acide acétique glacial est utilisé comme solvant dans les synthèses organiques.
Index des articles
- 1 Histoire
- 1,1 1800
- 1,2 1900
- 2 Structure de l'acide acétique
- 3 Propriétés physiques et chimiques
- 3.1 Noms chimiques
- 3.2 Formule moléculaire
- 3.3 Apparence physique
- 3.4 Odeur
- 3.5 Saveur
- 3.6 Point d'ébullition
- 3.7 Point de fusion
- 3.8 Point d'éclair
- 3.9 Solubilité dans l'eau
- 3.10 Solubilité dans les solvants organiques
- 3.11 Densité
- 3.12 Densité de vapeur
- 3.13 Pression de vapeur
- 3.14 Décomposition
- 3.15 Viscosité
- 3.16 Corrosivité
- 3.17 Chaleur de combustion
- 3.18 Chaleur de vaporisation
- 3,19 pH
- 3.20 Tension superficielle
- 3,21 pKa
- 3.22 Réactions chimiques
- 4 Production
- 4.1 Fermentation oxydative ou aérobie
- 4.2 Fermentation anaérobie
- 4.3 Carbonylation du méthanol
- 4.4 Oxydation de l'acétaldéhyde
- 5 utilisations
- 5.1 Industriel
- 5.2 En tant que solvant
- 5.3 Médecins
- 5.4 Dans les aliments
- 6 Références
Histoire
L'homme appartenant à de nombreuses cultures, a utilisé la fermentation de nombreux fruits, légumineuses, céréales, etc., pour obtenir des boissons alcoolisées, produit de la transformation de sucres, tels que le glucose, en éthanol, CH3CHdeuxOh.
Probablement parce que la méthode initiale de production d'alcool et de vinaigre est la fermentation, peut-être en essayant de produire de l'alcool à une heure indéterminée, il y a plusieurs siècles, le vinaigre a été obtenu par erreur. Notez la similitude entre les formules chimiques de l'acide acétique et de l'éthanol.
Dès le IIIe siècle av.J.-C., le philosophe grec Théophastus décrivait l'action du vinaigre sur les métaux pour la production de pigments, comme le blanc de plomb.
1800
En 1823, un équipement en forme de tour est conçu en Allemagne pour la fermentation aérobie de différents produits, afin d'obtenir de l'acide acétique sous forme de vinaigre..
En 1846, Herman Foelbe a réalisé pour la première fois la synthèse de l'acide acétique grâce à l'utilisation de composés inorganiques. La synthèse a commencé par la chloration du disulfure de carbone et s'est terminée, après deux réactions, par une réduction électrolytique en acide acétique.
À la fin du 19e siècle et au début du 20e siècle, grâce aux recherches de J. Weizmann, la bactérie Clostridium acetobutylicum a commencé à être utilisée pour la production d'acide acétique, par fermentation anaérobie..
1900
Au début du 20e siècle, la technologie dominante était la production d'acide acétique par oxydation de l'acétaldéhyde.
En 1925, Henry Dreyfus de la société britannique Celanese, conçoit une usine pilote pour la carbonylation du méthanol. Plus tard, en 1963, la société allemande BASF a introduit l'utilisation du cobalt comme catalyseur.
Otto Hromatka et Heinrich Ebner (1949), ont conçu une cuve avec un système d'agitation et une alimentation en air pour la fermentation aérobie, destinée à la production de vinaigre. Cet outil, avec quelques adaptations, est toujours utilisé.
En 1970, la société nord-américaine Montsanto utilisait un système de catalyseur à base de rhodium pour la carbonylation du méthanol..
Par la suite, la société BP a introduit en 1990 le procédé Cativa avec l'utilisation du catalyseur à l'iridium dans le même but. Cette méthode s'est avérée plus efficace et moins agressive pour l'environnement que la méthode Montsanto..
Structure de l'acide acétique
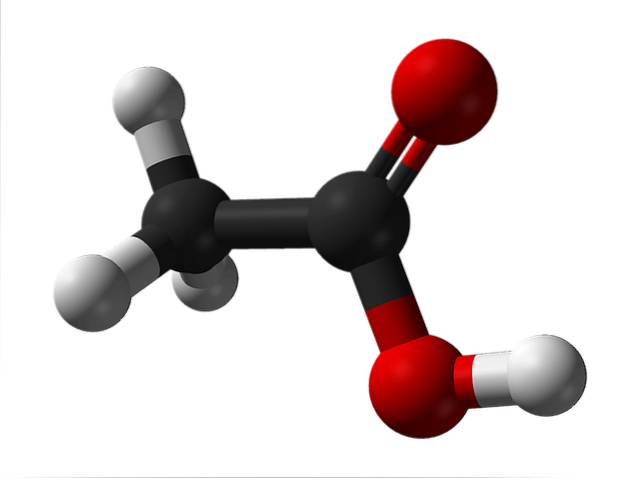
L'image du haut montre la structure de l'acide acétique représentée avec un modèle de sphères et de barres. Les sphères rouges correspondent aux atomes d'oxygène, qui appartiennent à leur tour au groupe carboxyle -COOH. C'est donc un acide carboxylique. Sur le côté droit de la structure se trouve le groupe méthyle, -CH3.
Comme on peut le voir, c'est une molécule très petite et simple. Il présente un moment dipolaire permanent dû au groupe -COOH, qui permet également à l'acide acétique de former deux liaisons hydrogène consécutivement.
Ce sont ces ponts qui orientent spatialement les molécules CH.3COOH pour former des dimères à l'état liquide (et gazeux).

Ci-dessus dans l'image, vous pouvez voir comment les deux molécules sont disposées pour former les deux liaisons hydrogène: O-H-O et O-H-O. Pour évaporer l'acide acétique, il faut fournir suffisamment d'énergie pour rompre ces interactions; raison pour laquelle il s'agit d'un liquide avec un point d'ébullition supérieur à celui de l'eau (118 ° C environ).
Proprietes physiques et chimiques
Noms chimiques
Acide:
-Acétique
-Éthanoïque
-Éthyle
Formule moléculaire
CdeuxH4OU ALORSdeux ou CH3COOH.
Aspect physique
Liquide incolore.
Odeur
Acre caractéristique.
Goût
Brûlant.
Point d'ébullition
244 ° F à 760 mmHg (117,9 ° C).
Point de fusion
61,9 ºF (16,6 ºC).
point d'allumage
112 ° F (tasse ouverte) 104 ° F (tasse fermée).
Solubilité dans l'eau
dix6 mg / mL à 25 ºC (il est miscible dans toutes les proportions).
Solubilité dans les solvants organiques
Il est soluble dans l'éthanol, l'éther éthylique, l'acétone et le benzène. Il est également soluble dans le tétrachlorure de carbone.
Densité
1,051 g / cm3 à 68 ° F (1 044 g / cm3 à 25 ° C).
Densité de vapeur
2,07 (par rapport à l'air = 1).
La pression de vapeur
15,7 mmHg à 25 ºC.
Décomposition
Lorsqu'il est chauffé au-dessus de 440 ºC, il se décompose pour produire du dioxyde de carbone et du méthane.
Viscosité
1056 mPascal à 25 ºC.
Corrosivité
L'acide acétique glacial est très corrosif et son ingestion peut provoquer de graves lésions de l'œsophage et du pylore chez l'homme..
Chaleur de combustion
874,2 kJ / mol.
Chaleur de vaporisation
23,70 kJ / mol à 117,9 ºC.
23,36 kJ / mol à 25,0 ºC.
pH
-Une solution de concentration 1 M a un pH de 2,4
- Pour une solution 0,1 M, son pH est de 2,9
- Et 3,4 si la solution est de 0,01 M
Tension superficielle
27,10 mN / m à 25 ºC.
pKa
4,76 à 25 ° C.
Réactions chimiques
L'acide acétique est corrosif pour de nombreux métaux, libérant du gaz Hdeux et la formation de sels métalliques appelés acétates. À l'exception de l'acétate de chrome (II), les acétates sont solubles dans l'eau. Sa réaction avec le magnésium est représentée par l'équation chimique suivante:
Mg (s) + 2 CH3COOH (ag) => (CH3ROUCOULER)deuxMg (ag) + Hdeux (g)
Par réduction, l'acide acétique forme de l'éthanol. Il peut également former de l'anhydride acétique à partir de la perte d'eau de deux molécules d'eau..
Production
Comme indiqué précédemment, la fermentation produit de l'acide acétique. Cette fermentation peut être aérobie (en présence d'oxygène) ou anaérobie (sans oxygène).
Fermentation oxydative ou aérobie
Les bactéries du genre Acetobacter peuvent agir sur l'éthanol ou l'alcool éthylique, provoquant son oxydation en acide acétique sous forme de vinaigre. Par cette méthode, du vinaigre avec une concentration de 20% d'acide acétique peut être produit..
Ces bactéries sont capables de produire du vinaigre, agissant sur une grande variété d'intrants qui incluent différents fruits, des légumineuses fermentées, du malt, des céréales comme le riz ou d'autres légumes qui contiennent ou peuvent produire de l'alcool éthylique..
La réaction chimique facilitée par les bactéries du genre Acetobacter est la suivante:
CH3CHdeuxOH + Odeux => CH3COOH + HdeuxOU ALORS
La fermentation oxydative est réalisée dans des cuves avec agitation mécanique et apport d'oxygène..
Fermentation anaérobie
Elle repose sur la capacité de certaines bactéries à produire de l'acide acétique en agissant directement sur les sucres, sans nécessiter de substances intermédiaires pour la production d'acide acétique..
C6H12OU ALORS6 => 3CH3COOH
La bactérie qui intervient dans ce processus est Clostridium acetobutylicum, qui est capable d'intervenir dans la synthèse d'autres composés, en plus de l'acide acétique..
Les bactéries acétogènes peuvent produire de l'acide acétique, agissant sur des molécules constituées d'un seul atome de carbone; c'est le cas du méthanol et du monoxyde de carbone.
La fermentation anaérobie est moins coûteuse que la fermentation oxydative, mais elle a la limitation que les bactéries du genre Clostridium ne sont pas très résistantes à l'acidité. Cela limite sa capacité à produire du vinaigre avec une concentration élevée d'acide acétique, comme cela est obtenu dans la fermentation oxydative..
Carbonylation du méthanol
Le méthanol peut réagir avec le monoxyde de carbone pour produire de l'acide acétique en présence de catalyseurs
CH3OH + CO => CH3COOH
En utilisant l'iodométhane comme catalyseur, la carbonylation du méthanol se déroule en trois étapes:
Dans un premier temps, l'acide iodhydrique (HI) réagit avec le méthanol, produisant de l'iodométhane, qui réagit dans un second temps avec le monoxyde de carbone, formant le composé iodo acétaldéhyde (CH3COI). Ensuite, le CH3COI hydrate pour produire de l'acide acétique et régénérer HI.
Le procédé Monsanto (1966) est une méthode de fabrication d'acide acétique par carbonylation catalytique du méthanol. Il est développé à une pression de 30 à 60 atm, à une température de 150 à 200 ºC, et en utilisant un système de catalyseur au rhodium..
Le procédé Monsanto a été largement remplacé par le procédé Cativa (1990) mis au point par BP Chemicals LTD, qui utilise un catalyseur à l'iridium. Ce procédé est moins cher et moins polluant.
Oxydation de l'acétaldéhyde
Cette oxydation nécessite des catalyseurs métalliques tels que les naphténates, les sels de manganèse, le cobalt ou le chrome..
2 CH3CHO + Odeux => 2 CH3COOH
L'oxydation de l'acétaldéhyde peut avoir un rendement très élevé pouvant atteindre 95% avec des catalyseurs appropriés. Les produits secondaires de la réaction sont séparés de l'acide acétique par distillation.
Après la méthode de carbonylation du méthanol, l'oxydation de l'acétaldéhyde est la deuxième forme en pourcentage de la production industrielle d'acide acétique.
Applications
Industriel
-L'acide acétique réagit avec l'éthylène en présence d'oxygène pour former un monomère d'acétate de vinyle, en utilisant du palladium comme catalyseur de réaction. L'acétate de vinyle polymérise en acétate de polyvinyle, qui est utilisé comme composant dans les peintures et les matériaux adhésifs..
-Réagit avec différents alcools pour produire des esters, notamment l'acétate d'éthyle et l'acétate de propyle. Les esters d'acétate sont utilisés comme solvants pour les encres, la nitrocellulose, les revêtements, les vernis et les laques acryliques..
-Par la condensation de deux molécules d'acide acétique, perdant une molécule d'une molécule, l'anhydride acétique, CH3CO-O-COCH3. Ce composé est impliqué dans la synthèse de l'acétate de cellulose, un polymère qui constitue un tissu synthétique et est utilisé dans la production de films photographiques..
En tant que solvant
-C'est un solvant polaire capable de former des liaisons hydrogène. Il est capable de dissoudre des composés polaires tels que des sels inorganiques et des sucres, mais il dissout également des composés non polaires tels que des huiles et des graisses. De plus, l'acide acétique est miscible avec les solvants polaires et non polaires..
-La miscibilité de l'acide acétique dans les alcanes dépend de l'extension de la chaîne de ceux-ci: à mesure que la longueur de la chaîne des alcanes augmente, sa miscibilité avec l'acide acétique diminue.
Médecins
-L'acide acétique dilué est utilisé comme antiseptique, appliqué localement, avec la capacité d'attaquer des bactéries telles que les streptocoques, les staphylocoques et les pseudomonas. En raison de cette action, il est utilisé dans le traitement des infections cutanées.
-L'acide acétique est utilisé en endoscopie de l'œsophage de Barrett. Il s'agit d'une condition dans laquelle la muqueuse œsophagienne change, devenant similaire à la muqueuse de l'intestin grêle..
-Un gel d'acide acétique à 3% semble être un complément efficace au traitement avec le médicament vaginal Misoprostol, induisant un avortement médicamenteux au cours du trimestre moyen, en particulier chez les femmes avec un pH vaginal de 5 ou plus..
-Il est utilisé comme substitut au peeling chimique. Cependant, des complications sont survenues avec cette utilisation, puisqu'au moins un cas de brûlures subies par un patient a été rapporté.
Dans la nourriture
Le vinaigre est utilisé depuis longtemps comme assaisonnement et arôme dans les aliments, ce qui en fait l'application la plus connue de l'acide acétique..
Les références
- Byju's. (2018). Qu'est-ce que l'acide éthanoïque? Récupéré de: byjus.com
- PubChem. (2018). Acide acétique. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2018). Acide acétique. Récupéré de: en.wikipedia.org
- Livre chimique. (2017). L'acide acétique glacial. Récupéré de: Chemicalbook.com
- Acide acétique: qu'est-ce que c'est et à quoi sert-il? Rétabli: acidoacetico.info
- Helmenstine, Anne Marie, Ph.D. (22 juin 2018). Qu'est-ce que l'acide acétique glacial? Récupéré de: thinkco.com


Personne n'a encore commenté ce post.