
Propriétés, risques et utilisations de l'acide arsénique (H3AsO4)
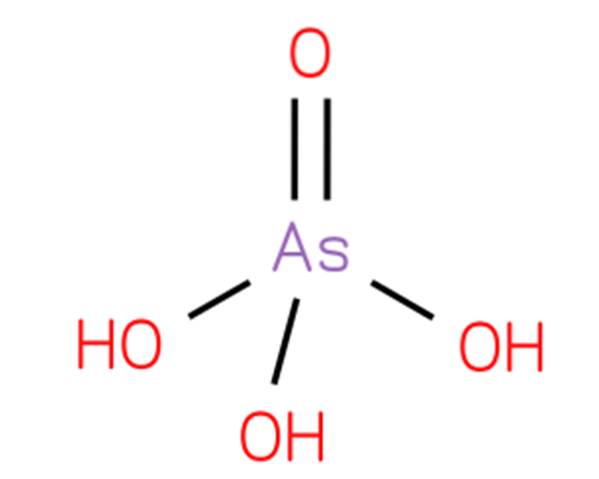
le acide arsénique, L'arséniate d'hydrogène ou acide orthoarsénique, est un composé chimique dont la formule est H3AsO4. Un oxacide d'arsenic comprend un groupe oxo et trois groupes hydroxyle liés à un atome central d'arsenic. Sa structure est présentée sur la figure 1 (CHEBI: 18231 - acide arsénique, S.F.).
Sa structure est analogue à celle de l'acide phosphorique (Royal Society of Chemistry, 2015) et peut être réécrite comme AsO (OH) 3. Ce composé est préparé en traitant le trioxyde d'arsenic avec de l'oxyde nitrique selon la réaction: As2O3 + 2HNO3 + 2H2O → 2H3AsO4 + N2O3.
La solution résultante est refroidie pour donner des cristaux incolores de l'hémihydrate H3AsO4 · ½H2O, bien que le dihydrate H3AsO4 · 2H2O se produise lorsque la cristallisation a lieu à des températures plus basses (Budavari, 1996).
L'acide arsénique est un composé extrêmement toxique. De nombreuses fiches de données de sécurité conseillent d'éviter tout contact si possible.
Index des articles
- 1 Propriétés physiques et chimiques de l'acide arsénique
- 2 Réactivité et dangers
- 2.1 En cas de contact avec les yeux
- 2.2 En cas de contact cutané
- 2.3 En cas d'ingestion
- 2.4 En cas d'inhalation
- 3 utilisations
- 4 Références
Propriétés physiques et chimiques de l'acide arsénique
L'acide arsénique est un solide hygroscopique blanc. Son apparence est illustrée à la figure 2.

En solution aqueuse, il s'agit d'un liquide hygroscopique visqueux et transparent (National Center for Biotechnology Information., 2017). Son poids moléculaire est de 141,94 g / mol et sa densité de 2,5 g / ml. Son point de fusion est de 35,5 ° C et son point d'ébullition est de 120 ° C où il se décompose.
L'acide arsénique est très soluble dans l'eau, pouvant dissoudre 16,7 g pour 100 ml, il est également soluble dans l'alcool. Le composé a un pKa de 2,19 pour la première déprotonation et de 6,94 et 11,5 pour la deuxième et la troisième déprotonation (Royal Society of Chemistry, 2015).
L'acide arsénique est un agent oxydant. Peut corroder l'acier et réagit avec les métaux galvanisés et le laiton.
Les solutions d'acide arsénique peuvent développer de l'arsine gazeuse (AsH3) très toxique au contact de métaux actifs, tels que le zinc et l'aluminium. Lorsqu'il est chauffé jusqu'à décomposition, il produit des vapeurs toxiques d'arsenic métallique.
La solution est légèrement acide et un agent oxydant faible. Réagit avec les alcalis pour générer de la chaleur et précipiter les arsénates (ARSENIC ACID, LIQUID, 2016).
Réactivité et dangers
L'acide arsénique est un composé stable et incombustible qui peut être corrosif pour les métaux. Le composé est hautement toxique et cancérigène confirmé pour l'homme.
L'inhalation, l'ingestion ou le contact cutané avec le produit peut provoquer des blessures graves ou la mort. Le contact avec la substance fondue peut provoquer de graves brûlures de la peau et des yeux..
Evitez tout contact avec la peau. Les effets du contact ou de l'inhalation peuvent être retardés. Le feu peut produire des gaz irritants, corrosifs et / ou toxiques. Les eaux usées des produits de lutte contre l'incendie ou de dilution peuvent être corrosives et / ou toxiques et provoquer une contamination.
Les symptômes d'intoxication à l'acide arsénique sont la toux et l'essoufflement en cas d'inhalation. Il peut également y avoir des rougeurs sur la peau, des douleurs et une sensation de brûlure si elle entre en contact avec elle. Enfin, les symptômes en cas d'ingestion sont des rougeurs et des douleurs dans les yeux, des maux de gorge, des nausées, des vomissements, des diarrhées et des convulsions..
En cas de contact avec les yeux
Ils doivent être lavés à grande eau pendant au moins 15 minutes, en soulevant sporadiquement les paupières supérieures et inférieures jusqu'à ce qu'il n'y ait plus de traces de résidus chimiques..
En cas de contact cutané
Se laver immédiatement et abondamment à l'eau et au savon pendant au moins 15 minutes tout en retirant les vêtements et chaussures contaminés. Couvrir les brûlures avec un pansement stérile sec (sécurisé, non étanche).
En cas d'ingestion
Rincer la bouche et fournir à la victime consciente de grandes quantités d'eau pour diluer l'acide. Dans ce cas, un lavage gastrique doit être utilisé et les vomissements ne doivent pas être provoqués..
En cas d'inhalation
La respiration artificielle doit être pratiquée si nécessaire. La méthode du bouche-à-bouche ne doit pas être utilisée si la victime a ingéré ou inhalé la substance..
La respiration artificielle doit être pratiquée à l'aide d'un masque de poche équipé d'une valve unidirectionnelle ou d'un autre appareil médical respiratoire approprié. La victime doit être déplacée dans un endroit frais et maintenue au chaud et au repos..
Dans tous les cas, une attention médicale immédiate doit être recherchée (National Institute for Occupational Safety and Health, 2015).
L'acide arsénique est nocif pour l'environnement. La substance est très toxique pour les organismes aquatiques. Des mesures doivent être prises pour limiter la libération de ce composé chimique.
Applications
L'acide arsénique, compte tenu de sa forte toxicité, a des utilisations limitées. Cependant, ce composé a été utilisé comme pesticide et stérilisant du sol, bien qu'il soit actuellement obsolète (University of Hertfordshire, 2016).
Il est également utilisé dans la transformation du bois et comme déshydratant dans la production de coton depuis 1995. La pulvérisation des plantes permet aux feuilles de sécher rapidement sans tomber. La plante doit être suffisamment sèche pour que les capsules de coton puissent sortir facilement.
L'acide arsénique est utilisé dans la production de verre. Bien que les dossiers considèrent la substance comme un intermédiaire, cette utilisation d'acide arsénique ressemble davantage à un «agent de traitement», similaire à l'utilisation du trioxyde de diarsénique (As2O3) comme agent de finition..
Ce composé rompt les liaisons oxygène entre les autres éléments par la réaction redox et produit de l'oxygène gazeux qui aide à éliminer les bulles dans le verre (Position Paper of the European Glass Industries on the, 2012).
L'acide arsanilique ou acide 4-aminophénylarsonique est un dérivé de l'acide orthoarsénique. Il est utilisé comme médicament vétérinaire antibactérien arsenical utilisé dans la prévention et le traitement de la dysenterie porcine (ARSENIC ACID, S.F.).
L'arséniate est le sel ou l'ester de l'acide arsénique qui a un ion négatif d'AsO43-. L'arséniate ressemble au phosphate à bien des égards, car l'arsenic et le phosphore se trouvent dans le même groupe (colonne) du tableau périodique..
L'arséniate peut remplacer le phosphate inorganique au stade de la glycolyse qui produit du 1,3-bisphosphoglycérate, produisant à la place du 1-arsenic-3-phosphoglycérate. Cette molécule est instable et s'hydrolyse rapidement, formant le prochain intermédiaire en cours de route, le 3-phosphoglycérate..
Par conséquent, la glycolyse continue, mais la molécule d'ATP qui serait générée à partir du 1,3-bisphosphoglycérate est perdue. L'arséniate est un découpleur de glycolyse, ce qui explique sa toxicité.
Certaines espèces de bactéries obtiennent leur énergie en oxydant divers combustibles tout en réduisant l'arséniate pour former des arsénites. Les enzymes impliquées sont connues sous le nom d'arséniate réductases..
En 2008, des bactéries ont été découvertes qui utilisent une version de la photosynthèse avec des arsénites comme donneurs d'électrons, produisant de l'arséniate (tout comme la photosynthèse ordinaire utilise l'eau comme donneur d'électrons, produisant de l'oxygène moléculaire).
Les chercheurs ont supposé qu'historiquement, ces organismes photosynthétiques produisaient l'arséniate qui permettait aux bactéries réductrices d'arséniate de se développer (Human Metabolome Database, 2017).
Les références
- ACIDE ARSENIQUE. (S.F.). Récupéré de chemicalland21.com.
- ACIDE ARSENIQUE, LIQUIDE. (2016). Récupéré de cameochemicals.noaa.gov.
- Budavari, S. (. (1996). Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. Whitehouse Station, NJ: Merck and Co.
- CHEBI: 18231 - acide arsénique. (S.F.). Récupéré de ebi.ac.uk.
- Base de données du métabolome humain. (2017, 2 mars). Affichage de la metabocard pour l'arséniate. Récupéré de hmdb.ca.
- Centre national d'information sur la biotechnologie… (4 mars 2017). Base de données des composés PubChem; CID = 234,. Récupéré de PubChem.
- Institut national pour la sécurité et la santé au travail. (2015, 22 juillet). ACIDE ARSENIQUE. Récupéré de cdc.gov.
- Prise de position des industries du verre européennes sur le. (2012, 18 septembre). Récupéré de glassallianceeurope.
- Société royale de chimie. (2015). Acide arsénique. Récupéré de chemspider.
- Société royale de chimie. (2015). Acide phosphorique. Récupéré de chemspider.
- Université du Hertfordshire. (2016, 13 janvier). acide arsénique. Récupéré de PPDB.



Personne n'a encore commenté ce post.