
Histoire du brome, structure, configuration électronique, propriétés, utilisations
le brome C'est un élément non métallique qui appartient au groupe des halogènes, groupe 17 (VIIA) du tableau périodique. Son symbole chimique est Br. Il apparaît comme une molécule diatomique, dont les atomes sont liés par une liaison covalente, pour laquelle on lui attribue la formule moléculaire Brdeux.
Contrairement au fluor et au chlore, le brome en conditions terrestres n'est pas un gaz mais un liquide brun rougeâtre (image ci-dessous). C'est fumant, et c'est avec le mercure, les seuls éléments liquides. En dessous, l'iode, bien qu'il intensifie sa couleur et vire au violet, peut cristalliser en un solide volatil.

Le brome a été découvert indépendamment en 1825 par Carl Löwig, qui étudiait sous la direction du chimiste allemand Leopold Gmelin; et en 1826, par le chimiste français Antoine-Jérome Balard. Cependant, la publication des résultats expérimentaux de Balard a précédé celle de Löwig..
Le brome est le 62e élément le plus abondant sur Terre, étant distribué en faibles concentrations dans toute la croûte terrestre. En mer, la concentration moyenne est de 65 ppm. Le corps humain contient 0,0004% de brome et sa fonction n'est pas définitivement connue..
Cet élément est exploité commercialement dans des saumures ou des lieux qui, en raison de conditions particulières, sont des lieux à forte concentration de sels; par exemple, la mer Morte, vers laquelle convergent les eaux des territoires voisins, saturée de sels.
C'est un élément corrosif capable d'attaquer les métaux, tels que le platine et le palladium. Dissous dans l'eau, le brome peut également exercer son action corrosive sur les tissus humains, aggravant la situation car de l'acide bromhydrique peut être généré. En ce qui concerne sa toxicité, il peut causer des dommages importants aux organes, tels que le foie, les reins, les poumons et l'estomac.
Le brome est très nocif dans l'atmosphère, étant 40 à 100 fois plus destructeur pour la couche d'ozone que le chlore. La moitié de la perte de la couche d'ozone en Antarctique est produite par des réactions liées au bromométhyle, un composé utilisé comme fumigant.
Il a de nombreuses utilisations, telles que: ignifuge, agent de blanchiment, désinfectant de surface, additif pour carburant, intermédiaire dans la fabrication de sédatif, dans la fabrication de produits chimiques organiques, etc..
Index des articles
- 1 Histoire
- 1.1 Le travail de Carl Löwig
- 1.2 L'œuvre d'Antoine Balard
- 2 Structure et configuration électronique du brome
- 2.1 Molécule
- 2.2 Cristaux
- 2.3 Couche de Valence et états d'oxydation
- 3 propriétés
- 3.1 Apparence physique
- 3.2 Poids atomique
- 3.3 numéro atomique
- 3.4 Odeur
- 3.5 Point de fusion
- 3.6 Point d'ébullition
- 3.7 Densité (Br2) liquide
- 3.8 Solubilité dans l'eau
- 3.9 Solubilités
- 3.10 Point triple
- 3.11 Point critique
- 3.12 Chaleur de fusion (Br2)
- 3.13 Chaleur de vaporisation (Br2)
- 3.14 Capacité thermique molaire (Br2)
- 3.15 Pression de vapeur
- 3.16 Température d'auto-inflammation
- 3.17 Point d'éclair
- 3.18 Température de stockage
- 3.19 Tension superficielle
- 3.20 Seuil olfactif
- 3.21 Indice de réfraction (ηD)
- 3.22 Electronégativité
- 3.23 Énergie d'ionisation
- 3.24 Rayon atomique
- 3.25 Rayon covalent
- 3.26 Rayon de Van der Waals
- 3.27 Réactivité
- 4 utilisations
- 4.1 Additif pour essence
- 4.2 Pesticides
- 4.3 Contrôle des émissions de mercure
- 4.4 Photographie
- 4.5 Actions thérapeutiques
- 4.6 Ignifuge
- 4.7 Additif alimentaire
- 4.8 Réactifs et intermédiaire chimique
- 4.9 Action biologique
- 5 Où trouver
- 6 risques
- 7 Références
Histoire
Œuvre de Carl Löwig
Le brome a été découvert indépendamment et presque simultanément par Carl Jacob Löwig, un chimiste allemand en 1825, et par Antoine Balard, un chimiste français en 1826..
Carl Löwig, un disciple du chimiste allemand Leopold Gmelin, a recueilli de l'eau d'une source à Bad Kreuznach et y a ajouté du chlore; après l'addition de l'éther, le mélange liquide a été agité.
Ensuite, l'éther a été chassé par distillation et concentré par évaporation. En conséquence, il a obtenu une substance brun rougeâtre, qui était du brome.
Œuvre d'Antoine Balard
Balard, pour sa part, utilise les cendres d'une algue brune appelée fucus et les mélange avec de la saumure, extraite des salines de Montpellier. Ainsi, il a libéré le brome, faisant passer le chlore à travers la matière aqueuse soumise à l'extraction, dans laquelle le bromure de magnésium, MgBr, était présent.deux.
Par la suite, le matériau a été distillé en présence de dioxyde de manganèse et d'acide sulfurique, produisant des vapeurs rouges qui se sont condensées en un liquide sombre. Balard pensait que c'était un élément nouveau et l'appelait muride, dérivé du mot latin muria, avec lequel la saumure était désignée.
Il a été noté que Balard a changé le nom de muride en brôme à la suggestion d'Anglada ou Gay-Lussac, basé sur le fait que brôme signifie sale, ce qui définit l'odeur de l'élément découvert..
Les résultats ont été publiés par Belard dans Annales of Chemie and Physique, avant que Löwig ne publie son.
Ce n'est qu'à partir de 1858 qu'il est possible de produire du brome en quantités importantes; année où les gisements de sel de Stassfurt ont été découverts et exploités, produisant du brome comme sous-produit de la potasse.
Structure et configuration électronique du brome
Molécule

L'image du haut montre la molécule de brome, Brdeux, avec un modèle de remplissage compact. En fait, il existe une simple liaison covalente entre les deux atomes de brome, Br-Br.
Étant une molécule homogène et diatomique, elle n'a pas de moment dipolaire permanent et ne peut interagir avec d'autres du même type qu'au moyen des forces de dispersion de Londres..
C'est la raison pour laquelle son liquide rougeâtre fume; dans les molécules de Brdeux, bien que relativement lourds, leurs forces intermoléculaires les maintiennent lâchement ensemble.
Le brome est moins électronégatif que le chlore, et a donc un effet moins attractif sur les électrons dans les coques de valence. En conséquence, il nécessite moins d'énergie pour parcourir des niveaux d'énergie plus élevés, absorber les photons verts et refléter une couleur rougeâtre..
Cristaux
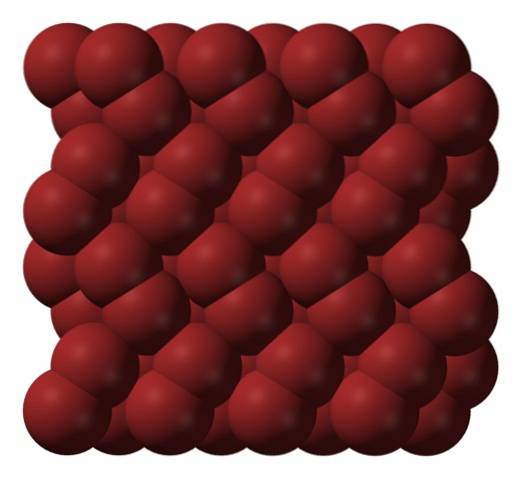
En phase gazeuse, les molécules de Brdeux ils se séparent considérablement jusqu'à ce qu'il n'y ait pas d'interactions efficaces entre eux. Cependant, en dessous de son point de fusion, le brome peut geler en cristaux orthorhombiques rougeâtres (image du haut).
Notez comment les molécules Brdeux ils sont disposés proprement de manière à ressembler à des «vers de brome». Ici et à ces températures (T < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Couche de valence et états d'oxydation
La configuration électronique du brome est:
[Ar] 3ddix4 sdeux 4p5
Être 3ddix4 sdeux 4p5 sa coquille de valence (bien que l'orbitale 3ddix ne jouent pas un rôle de premier plan dans leurs réactions chimiques). Les électrons dans les orbitales 4s et 4p sont les plus externes et totalisent 7, juste un électron après avoir terminé l'octet de valence.
De cette configuration on peut déduire les états d'oxydation possibles du brome: -1, s'il gagne un électron pour être isoélectronique au krypton; +1, restant en 3ddix4 sdeux 4p4; +3, +4 et +5, perdant tous les électrons de l'orbitale 4p ([Ar] 3ddix4 sdeux4p0); et +7, ne laissant aucun électrons dans l'orbitale 4s ([Ar] 3ddix4 s04p0).
Propriétés
Aspect physique
Liquide fumant brun rougeâtre foncé. Il se trouve dans la nature sous forme de molécule diatomique, avec les atomes liés par une liaison covalente. Le brome est un liquide plus dense que l'eau et s'y enfonce.
Poids atomique
79,904 g / mol.
Numéro atomique
35.
Odeur
Une fumée piquante, suffocante et irritante.
Point de fusion
-7,2 ºC.
Point d'ébullition
58,8 ºC.
Densité (Brdeux) liquide
3,1028 g / cm3
Solubilité dans l'eau
33,6 g / L à 25 ° C La solubilité du brome dans l'eau est faible et tend à augmenter avec la diminution de la température; comportement similaire à d'autres gaz.
Solubilités
Librement soluble dans l'alcool, l'éther, le chloroforme, le tétrachlorure de carbone, le disulfure de carbone et l'acide chlorhydrique concentré. Soluble dans les solvants non polaires et certains solvants polaires tels que l'alcool, l'acide sulfurique et de nombreux solvants halogénés.
Point triple
265,9 K à 5,8 kPa.
Point critique
588 K à 10,34 MPa.
Chaleur de fusion (Brdeux)
10 571 kJ / mol.
Chaleur de vaporisation (Brdeux)
29,96 kJ / mol.
Capacité thermique molaire (Brdeux)
75,69 kJ / mol.
La pression de vapeur
À une température de 270 K, 10 kPa.
La température d'auto-inflammation
Non inflammable.
point d'allumage
113 ºC.
Température de stockage
2 à 8 ºC.
Tension superficielle
40,9 mN / m à 25 ºC.
Seuil d'odeur
0,05 à 3,5 ppm. 0,39 mg / m3
Indice de réfraction (ηD)
1,6083 à 20 ºC et 1,6478 à 25 ºC.
Électronégativité
2.96 sur l'échelle de Pauling.
Énergie d'ionisation
- Premier niveau: 1139,9 kJ / mol.
- Deuxième niveau: 2,103 kJ / mol.
- Troisième niveau: 3470 kJ / mol.
Radio atomique
120 h.
Rayon covalent
120h3.
Radio Van der Waals
185 h.
Réactivité
Il est moins réactif que le chlore, mais plus réactif que l'iode. C'est un oxydant moins fort que le chlore et plus fort que l'iode. C'est aussi un agent réducteur plus faible que l'iode, mais plus fort que le chlore..
La vapeur de chlore est très corrosive pour de nombreux matériaux et tissus humains. Attaque de nombreux éléments métalliques, dont le platine et le palladium; mais il n'attaque pas le plomb, le nickel, le magnésium, le fer, le zinc, et sous 300 ºC ni le sodium.
Le brome dans l'eau subit un changement et se transforme en bromure. Il peut également exister sous forme de bromate (BrO3-), en fonction du pH du liquide.
En raison de son action oxydante, le brome peut induire la libération de radicaux libres d'oxygène. Ce sont des oxydants puissants et peuvent endommager les tissus. De plus, le brome peut s'enflammer spontanément lorsqu'il est combiné avec du potassium, du phosphore ou de l'étain..
Applications
Additif essence
Le dibromure d'éthylène a été utilisé pour éliminer les dépôts potentiels de plomb des moteurs d'automobiles. Après la combustion de l'essence, qui utilisait du plomb comme additif, le brome combiné au plomb pour former du bromure de plomb, un gaz volatil qui était expulsé par le tuyau d'échappement..
Bien que le brome ait éliminé le plomb de l'essence, son action destructrice sur la couche d'ozone était très puissante, c'est pourquoi il a été jeté pour cette application..
Les pesticides
Le bromure de méthylène ou de bromométhyle a été utilisé comme pesticide pour purifier les sols, en particulier pour éliminer les nématodes parasites, tels que l'ankylostome..
Cependant, l'utilisation de la plupart des composés contenant du brome a été abandonnée en raison de leur action destructrice sur la couche d'ozone..
Contrôle des émissions de mercure
Le brome est utilisé dans certaines usines pour réduire les émissions de mercure, un métal très toxique..
La photographie
Le bromure d'argent, en plus de l'iodure d'argent et du chlorure d'argent, est utilisé comme composé sensible à la lumière dans les émulsions photographiques.
Actions thérapeutiques
Le bromure de potassium, ainsi que le bromure de lithium, ont été utilisés comme sédatifs généraux au XIXe et au début du XXe siècle. Les bromures sous forme de sels simples sont encore utilisés dans certains pays comme anticonvulsivants.
Cependant, la FDA américaine n'approuve aujourd'hui l'utilisation du brome pour le traitement d'aucune maladie..
Retardateur de flamme
Le brome est transformé par les flammes en acide bromhydrique, qui interfère avec la réaction d'oxydation qui se produit lors d'un incendie et provoque son extinction. Les polymères contenant du brome sont utilisés pour fabriquer des résines ignifuges.
Additif alimentaire
Des traces de bromate de potassium ont été ajoutées à la farine pour améliorer la cuisson.
Réactifs et intermédiaire chimique
Le bromure d'hydrogène est utilisé comme agent réducteur et catalyseur pour les réactions organiques. Le brome est utilisé comme intermédiaire chimique dans la fabrication de médicaments, de fluides hydrauliques, d'agents de refroidissement, de déshumidificateurs et dans les préparations à friser les cheveux.
Il trouve également une utilisation dans la production de fluides de forage de puits, de produits pour la désinfection de l'eau, d'agents de blanchiment, de désinfectants de surface, de colorants, d'additifs pour carburants, etc..
Action biologique
Une étude réalisée en 2014 indique que le brome est un cofacteur nécessaire à la biosynthèse du collagène IV, ce qui fait du brome un élément essentiel pour le développement des tissus animaux. Cependant, il n'y a aucune information sur les conséquences d'un déficit de l'élément.
Où est-il situé
Le brome est extrait commercialement des mines de sel et des fosses de saumure profondes trouvées dans l'État de l'Arkansas et dans le Grand lac salé de l'Utah, tous deux aux États-Unis. Cette dernière saumure a une concentration de brome de 0,5%.
Pour extraire le brome, le chlore gazeux chaud est ajouté à la saumure pour oxyder les ions bromure dans la solution, collectant le brome élémentaire..
La mer Morte, à la frontière entre la Jordanie et Israël, est une mer fermée qui se trouve en dessous du niveau de la mer, ce qui en fait une très forte concentration de sels.
Le brome et la potasse y sont obtenus commercialement, par évaporation de l'eau très salée de la mer Morte. Dans cette mer, la concentration de brome peut atteindre 5 g / L.
On le trouve également en fortes concentrations dans certaines sources chaudes. La brominite, par exemple, est un minéral de bromure d'argent trouvé en Bolivie et au Mexique..
Des risques
Le brome à l'état liquide est corrosif pour les tissus humains. Mais le plus grand danger pour l'homme vient des vapeurs de brome et de leur inhalation..
Respirer dans un environnement avec une concentration de brome de 11-23 mg / m3 produit des chocs violents. Une concentration de 30 à 60 mg / m3 c'est extrêmement nocif. Pendant ce temps, une concentration de 200 mg peut être fatale.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Centre national d'information sur la biotechnologie. (2019). Brome. Base de données PubChem. CID = 23968. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8 février 2017). Faits sur le brome. Récupéré de: livesscience.com
- Wikipédia. (2019). Borax. Récupéré de: en.wikipedia.org
- Lenntech B. V. (2019). Brome. Récupéré de: lenntech.com



Personne n'a encore commenté ce post.