
Structure de l'acide benzoïque, propriétés, production, utilisations
le acide benzoique est l'acide aromatique le plus simple de tous, ayant pour formule moléculaire C6H5COOH. Il doit son nom au fait qu'il a longtemps eu le benjoin comme source principale, une résine obtenue à partir de l'écorce de plusieurs arbres du genre Styrax..
On le trouve dans de nombreuses plantes, en particulier les fruits, comme les abricots et les myrtilles. Il est également produit dans les bactéries en tant que sous-produit du métabolisme de l'acide aminé phénylalanine. Il est également généré dans l'intestin par le traitement bactérien (oxydatif) des polyphénols présents dans certains aliments..

Comme on peut le voir dans l'image ci-dessus, le C6H5COOH est, contrairement à de nombreux acides, un composé solide. Son solide est constitué de cristaux légers, blancs et filiformes, qui dégagent un arôme d'amande.
Ces aiguilles sont connues depuis le XVIe siècle; par exemple, Nostradamus en 1556 décrit sa distillation sèche à partir de la gomme benjoin.
L'une des principales capacités de l'acide benzoïque est d'inhiber la croissance des levures, des moisissures et de certaines bactéries; pour lequel il est utilisé comme conservateur alimentaire. Cette action dépend du pH.
L'acide benzoïque a plusieurs actions médicinales, étant utilisé comme composant de produits pharmaceutiques utilisés dans le traitement de maladies de la peau telles que la teigne et le pied d'athlète. Il est également utilisé comme décongestionnant par inhalation, expectorant et analgésique.
Une forte proportion d'acide benzoïque produit industriellement est destinée à la production de phénol. De même, une partie de celui-ci est destinée à la production de benzoates de glycol, utilisés dans la fabrication de plastifiants..
Bien que l'acide benzoïque ne soit pas un composé particulièrement toxique, il a des effets nocifs pour la santé. Pour cette raison, l'OMS recommande une dose maximale de 5 mg / kg de poids corporel / jour, ce qui équivaut à un apport quotidien de 300 mg d'acide benzoïque..
Index des articles
- 1 Structure de l'acide benzoïque
- 1.1 Liaisons cristal et hydrogène
- 2 Propriétés physiques et chimiques
- 2.1 Noms chimiques
- 2.2 Formule moléculaire
- 2.3 Poids moléculaire
- 2.4 Description physique
- 2.5 Odeur
- 2.6 Saveur
- 2.7 Point d'ébullition
- 2.8 Point de fusion
- 2.9 Point d'éclair
- 2.10 Sublimation
- 2.11 Solubilité dans l'eau
- 2.12 Solubilité dans les solvants organiques
- 2.13 Densité
- 2.14 Densité de vapeur
- 2.15 Pression de vapeur
- 2.16 Stabilité
- 2.17 Décomposition
- 2.18 Viscosité
- 2.19 Chaleur de combustion
- 2.20 Chaleur de vaporisation
- 2,21 pH
- 2.22 Tension superficielle
- 2,23 pKa
- 2.24 Indice de réfraction
- 2.25 Réactions
- 3 Production
- 4 utilisations
- 4.1 Industriel
- 4.2 Médicinal
- 4.3 Conservation des aliments
- 4.4 Autres
- 5 Toxicité
- 6 Références
Structure de l'acide benzoïque
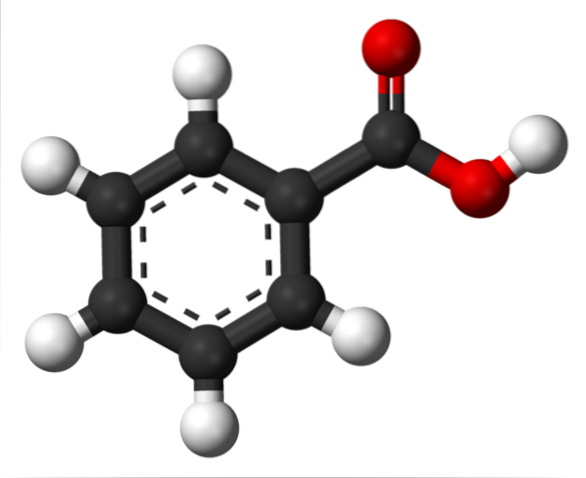
Dans l'image du haut, la structure de l'acide benzoïque est représentée avec un modèle de barres et de sphères. Si l'on compte le nombre de sphères noires, on vérifiera qu'il y en a six, c'est-à-dire six atomes de carbone; deux sphères rouges correspondent aux deux atomes d'oxygène du groupe carboxyle, -COOH; et enfin, les sphères blanches sont les atomes d'hydrogène.
Comme on peut le voir, à gauche se trouve le cycle aromatique, dont l'aromaticité est illustrée par les traits interrompus au centre de l'anneau. Et à droite, le groupe -COOH, responsable des propriétés acides de ce composé.
Moléculairement, le C6H5COOH a une structure plate, du fait que tous ses atomes (à l'exception des hydrogènes) ont une hybridation spdeux.
D'autre part, le groupe -COOH hautement polaire permet à un dipôle permanent d'exister dans la structure; dipôle visible au premier coup d'œil si sa carte de potentiel électrostatique était disponible.
Ce fait a pour conséquence que le C6H5COOH peut interagir avec lui-même par des forces dipôle-dipôle; spécifiquement, avec les liaisons hydrogène spéciales.
Si vous regardez le groupe -COOH, vous constaterez que l'oxygène dans C = O peut accepter une liaison hydrogène; tandis que l'oxygène de l'O-H, en fait don.
Liaisons cristal et hydrogène
L'acide benzoïque peut former deux liaisons hydrogène: il en reçoit et en accepte une simultanément. Par conséquent, il forme des dimères; c'est-à-dire que sa molécule est "liée" à une autre.
Ces paires ou dimères, C6H5COOH-HOOCC6H5, la base structurelle qui définit le solide résultant de sa disposition dans l'espace.
Ces dimères composent un plan de molécules qui, compte tenu de leurs interactions fortes et directionnelles, parviennent à établir un motif ordonné dans le solide. Les anneaux aromatiques participent également à cet ordre par des interactions par les forces de dispersion..
En conséquence, les molécules construisent un cristal monoclinique, dont les caractéristiques structurelles exactes peuvent être étudiées par des techniques instrumentales, telles que la diffraction des rayons X..
C'est à partir de là qu'une paire de molécules plates peut être disposée dans l'espace, principalement par liaison hydrogène, pour donner naissance à ces aiguilles blanches et cristallines..
Proprietes physiques et chimiques
Noms chimiques
Acide:
-benzoïque
-benzène carboxylique
-dracylique
-carboxybenzène
-benzèneoforme
Formule moléculaire
C7H6OU ALORSdeux ou C6H5COOH.
Poids moléculaire
122,123 g / mol.
Description physique
Solide ou sous forme de cristaux, généralement de couleur blanche, mais peut être de couleur beige s'il contient certaines impuretés. Ses cristaux sont squameux ou en forme d'aiguille (voir première image).
Odeur
Ça sent les amandes et c'est agréable.
Goût
Insipide ou légèrement amer. La limite de détection d'arôme est de 85 ppm.
Point d'ébullition
480 ° F à 760 mmHg (249 ° C).
Point de fusion
252,3 º F (121,5 à 123,5 ºC).
point d'allumage
250 ° F (121 ° C).
Sublimation
Il peut sublimer à partir de 100 ºC.
Solubilité dans l'eau
3,4 g / L à 25 ºC.
Solubilité dans les solvants organiques
-1 g d'acide benzoïque est dissous dans un volume égal à: 2,3 mL d'alcool froid; 4,5 ml de chloroforme; 3 ml d'éther; 3 ml d'acétone; 30 ml de tétrachlorure de carbone; 10 ml de benzène; 30 ml de disulfure de carbone; et 2,3 ml d'huile de térébenthine.
-Il est également soluble dans les huiles volatiles et fixes.
-Il est légèrement soluble dans l'éther de pétrole.
-Sa solubilité dans l'hexane est de 0,9 g / L, dans le méthanol 71,5 g / L et dans le toluène 10,6 g / L.
Densité
1,316 g / mL à 82,4 º F et 1,2659 g / mL à 15 ºC.
Densité de vapeur
4,21 (par rapport à l'air pris comme référence = 1)
La pression de vapeur
1 mmHg à 205 ° F et 7,0 x 10-4 mmHg à 25 ºC.
Stabilité
Une solution avec une concentration de 0,1% dans l'eau est stable pendant au moins 8 semaines.
Décomposition
Se décompose en chauffant, émettant une fumée âcre et irritante.
Viscosité
1,26 cPois à 130 ºC.
Chaleur de combustion
3227 KJ / mol.
Chaleur de vaporisation
534 KJ / mol à 249 ºC.
pH
Environ 4 dans l'eau.
Tension superficielle
31 N / m à 130 ºC.
pKa
4.19 à 25 ºC.
Indice de réfraction
1,504 - 1,5397 (ηD) à 20 ºC.
Réactions
-Au contact des bases (NaOH, KOH, etc.), il forme des sels de benzoate. Par exemple, s'il réagit avec NaOH, il forme du benzoate de sodium, C6H5COONa.
-Réagit avec les alcools pour former des esters. Par exemple, sa réaction avec l'alcool éthylique donne naissance à l'ester éthylique. Certains esters d'acide benzoïque servent de plastifiants.
-Réagit avec le pentachlorure de phosphore, PCl5, pour former du chlorure de benzoyle, un halogénure d'acide. Le chlorure de benzoyle peut réagir avec l'ammonium (NH3) ou une amine telle que la méthylamine (CH3NHdeux) pour former du benzamide.
-La réaction de l'acide benzoïque avec l'acide sulfurique produit la sulfonation du cycle aromatique. Le groupe fonctionnel -SO3H remplace un atome d'hydrogène en position méta du cycle.
-Il peut réagir avec l'acide nitrique, avec l'utilisation d'acide sulfurique comme catalyseur, formant de l'acide méta-nitrobenzoïque.
-En présence d'un catalyseur, tel que le chlorure ferrique, FeCl3, l'acide benzoïque réagit avec les halogènes; par exemple, réagit avec le chlore pour former de l'acide méta-chlorobenzoïque.
Production
Certaines méthodes de production de ce composé sont énumérées ci-dessous:
-La plupart de l'acide benzoïque est produit industriellement en oxydant le toluène avec de l'oxygène dans l'air. Le processus est catalysé par du naphténate de cobalt, à une température de 140-160 ºC et à une pression de 0,2 - 0,3 MPa.
-Le toluène, par contre, peut être chloré pour produire du benzotrichlorure, qui est ensuite hydrolysé en acide benzoïque..
-L'hydrolyse du benzonitrile et du benzamide, en milieu acide ou alcalin, peut donner naissance à l'acide benzoïque et à ses bases conjuguées..
-L'alcool benzylique dans une oxydation médiée par le permanganate de potassium, en milieu aqueux, produit de l'acide benzoïque. La réaction se produit par chauffage ou distillation au reflux. Une fois le processus terminé, le mélange est filtré pour éliminer le dioxyde de manganèse, tandis que le surnageant est refroidi pour obtenir de l'acide benzoïque..
-Le composé de benzotrichlorure est mis à réagir avec de l'hydroxyde de calcium, en utilisant du fer ou des sels de fer comme catalyseurs, formant initialement du benzoate de calcium, Ca (C6H5ROUCOULER)deux. Puis ce sel par réaction avec l'acide chlorhydrique est transformé en acide benzoïque.
Applications
Industriel
-Il est utilisé dans la production de phénol par décarboxylation oxydative de l'acide benzoïque à des températures de 300 à 400 ° C. Dans quel but? Parce que le phénol peut être utilisé dans la synthèse du nylon.
-À partir de là, il se forme du benzoate de glycol, un précurseur chimique de l'ester de diéthylèneglycol et de l'ester de triéthylèneglycol, substances utilisées comme plastifiants. Les formulations adhésives constituent peut-être l'application la plus importante des plastifiants. Certains esters à longue chaîne sont utilisés pour ramollir les plastiques comme le PVC.
-Il est utilisé comme activateur de polymérisation du caoutchouc. De plus, c'est un intermédiaire dans la fabrication de résines alkydes, ainsi que d'additifs pour des applications dans la récupération de pétrole brut..
-De plus, il est utilisé dans la production de résines, de colorants, de fibres, de pesticides et comme agent de modification de résine polyamide pour la production de polyester. Il est utilisé pour maintenir l'arôme du tabac.
-C'est un précurseur du chlorure de benzoyle, qui est une matière première pour la synthèse de composés tels que le benzoate de benzyle, utilisé dans la fabrication d'arômes artificiels et de répulsifs d'insectes..
Médicinal
-C'est un composant de la pommade Whitfield qui est utilisé pour traiter les affections cutanées fongiques telles que la teigne et le pied d'athlète. La pommade de Whitfield est composée à 6% d'acide benzoïque et à 3% d'acide salicylique..
-C'est un ingrédient de la teinture de benjoin qui a été utilisé comme antiseptique topique et décongestionnant par inhalation. L'acide benzoïque a été utilisé comme expectorant, analgésique et antiseptique jusqu'au début du 20e siècle.
-L'acide benzoïque a été utilisé dans le traitement expérimental de patients atteints de maladies à accumulation résiduelle d'azote.
La conservation des aliments
L'acide benzoïque et ses sels sont utilisés dans la conservation des aliments. Le composé est capable d'inhiber la croissance des moisissures, des levures et des bactéries, grâce à un mécanisme dépendant du pH..
Ils agissent sur ces organismes lorsque leur pH intracellulaire tombe à un pH inférieur à 5, inhibant presque totalement la fermentation anaérobie du glucose pour la production d'acide benzoïque. Cette action antimicrobienne nécessite un pH compris entre 2,5 et 4 pour une action plus efficace..
-Utilisé pour conserver les aliments tels que les jus de fruits, les boissons gazeuses, les sodas à l'acide phosphorique, les cornichons et autres aliments acidifiés.
Inconvénient
Il peut réagir avec l'acide ascorbique (vitamine C) présent dans certaines boissons, produisant du benzène, un composé cancérigène. Pour cette raison, nous recherchons d'autres composés capables de conserver les aliments qui ne présentent pas de problèmes d'acide benzoïque..
Autres
-Il est utilisé dans les emballages actifs, étant présent dans les films ionomères. De l'acide benzoïque en est libéré, capable d'inhiber la croissance d'espèces des genres Penicillium et Aspergillus dans les milieux microbiens..
-Il est utilisé comme agent de conservation de l'arôme du jus de fruit et du parfum. Il est également utilisé avec cette application dans le tabac.
-L'acide benzoïque est utilisé comme herbicide sélectif pour lutter contre les mauvaises herbes à larges feuilles et les graminées dans le soya, les concombres, les melons, les arachides et les plantes ornementales ligneuses..
Toxicité
-Au contact de la peau et des yeux, il peut provoquer des rougeurs. L'inhalation peut provoquer une irritation des voies respiratoires et de la toux. L'ingestion de grandes quantités d'acide benzoïque peut provoquer des troubles gastro-intestinaux pouvant entraîner des lésions hépatiques et rénales..
-L'acide benzoïque et les benzoates peuvent libérer de l'histamine, ce qui peut provoquer des réactions allergiques et une irritation des yeux, de la peau et des muqueuses..
-Il n'a pas d'effet cumulatif, mutagène ou cancérigène, car il est rapidement absorbé dans l'intestin, étant éliminé dans l'urine sans s'accumuler dans l'organisme..
-La dose maximale autorisée selon l'OMS est de 5 mg / kg de poids corporel / jour, soit environ 300 mg / jour. Dose de toxicité aiguë chez l'homme: 500 mg / kg.
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Livre chimique. (2017). Acide benzoique. Récupéré de: Chemicalbook.com
- PubChem. (2018). Acide benzoique. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wikipédia. (2018). Acide benzoique. Récupéré de: en.wikipedia.org
- Dadachanji, Dinshaw. (18 mai 2018). Propriétés chimiques de l'acide benzoïque. Découvrir. Récupéré de: scaimer.com
- Ministère du travail et des affaires sociales Espagne. (s.f.). Acide benzoique [PDF]. Cartes internationales de sécurité chimique. Récupéré de: insht.es



Personne n'a encore commenté ce post.