
Structure, propriétés, formation de l'acide bromhydrique (HBr)

le acide bromhydrique C'est un composé inorganique qui résulte de la dissolution aqueuse d'un gaz appelé bromure d'hydrogène. Sa formule chimique est HBr, et il peut être considéré de différentes manières équivalentes: comme un hydrure moléculaire, ou un halogénure d'hydrogène dans l'eau; c'est-à-dire un hydracide.
Dans les équations chimiques, il doit être écrit HBr (ac), indiquant ainsi qu'il s'agit de l'acide bromhydrique et non du gaz. Cet acide est l'un des plus forts connus, encore plus que l'acide chlorhydrique, HCl. L'explication de cela réside dans la nature de sa liaison covalente.
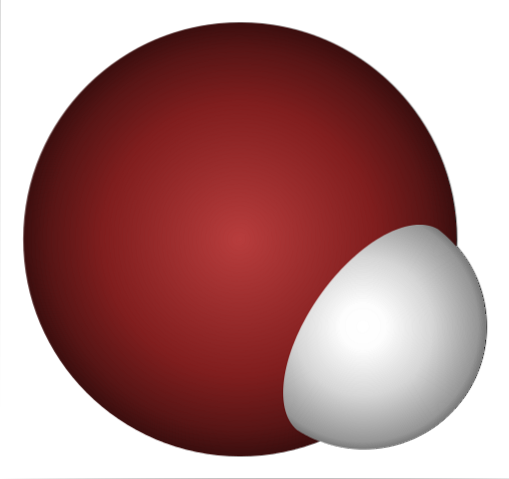
Pourquoi le HBr est-il un acide si fort et encore plus dissous dans l'eau? Parce que la liaison covalente H-Br est très faible, en raison du mauvais chevauchement des orbitales 1s de H et 4p de Br.
Cela n'est pas surprenant si vous regardez de près l'image ci-dessus, où clairement l'atome de brome (marron) est beaucoup plus grand que l'atome d'hydrogène (blanc).
Par conséquent, toute perturbation provoque la rupture de la liaison H-Br, libérant l'ion H+. Ainsi, l'acide bromhydrique est un acide Brönsted, car il transfère des protons ou des ions hydrogène. Sa force est telle qu'il est utilisé dans la synthèse de divers composés organobromés (comme le 1-Bromo éthane, CH3CHdeuxBr).
L'acide bromhydrique est, après l'hydroiodique, HI, l'un des hydracides les plus forts et les plus utiles pour la digestion de certains échantillons solides.
Index des articles
- 1 Structure de l'acide bromhydrique
- 1.1 Acidité
- 2 Propriétés physiques et chimiques
- 2.1 Formule moléculaire
- 2.2 Poids moléculaire
- 2.3 Apparence physique
- 2.4 Odeur
- 2.5 Seuil d'odeur
- 2.6 Densité
- 2.7 Point de fusion
- 2.8 Point d'ébullition
- 2.9 Solubilité dans l'eau
- 2.10 Densité de vapeur
- 2.11 Acidité pKa
- 2.12 Capacité calorique
- 2.13 Enthalpie molaire standard
- 2.14 Entropie molaire standard
- 2.15 Point d'éclair
- 3 Nomenclature
- 4 Comment se forme-t-il?
- 4.1 Mélange d'hydrogène et de brome dans l'eau
- 4.2 Tribromure de phosphore
- 4.3 Dioxyde de soufre et brome
- 5 utilisations
- 5.1 Préparation des bromures
- 5.2 Synthèse des halogénures d'alkyle
- 5.3 Catalyseur
- 6 Références
Structure de l'acide bromhydrique
L'image montre la structure de H-Br, dont les propriétés et caractéristiques, même si elles sont celles du gaz, sont étroitement liées à ses solutions aqueuses. C'est pourquoi il arrive un moment où il y a confusion quant à celui des deux composés auquel il est fait référence: HBr ou HBr (ac).
La structure de HBr (ac) est différente de celle de HBr, puisque maintenant les molécules d'eau résolvent cette molécule diatomique. Quand il est assez proche, le H est transféré+ à une molécule de HdeuxOu comme indiqué dans l'équation chimique suivante:
HBr + HdeuxO => Br-- + H3OU ALORS+
Ainsi, la structure de l'acide bromhydrique est constituée d'ions Br-- et H3OU ALORS+ interagissant électrostatiquement. Maintenant, c'est un peu différent de la liaison covalente de H-Br.
Sa forte acidité est due au volumineux anion Br- peut à peine interagir avec le H3OU ALORS+, incapable de vous empêcher de transférer le H+ à une autre espèce chimique environnante.
Acidité
Par exemple, Cl- et le F- bien qu'ils ne forment pas de liaisons covalentes avec H3OU ALORS+, ils peuvent interagir grâce à d'autres forces intermoléculaires, telles que les liaisons hydrogène (qui seulement F- est capable de les accepter). Liaisons hydrogène F--H-OHdeux+ "Empêcher" le don du H+.
C'est pour cette raison que l'acide fluorhydrique, HF, est un acide plus faible. dans l'eau que l'acide bromhydrique; puisque, les interactions ioniques Br- H3OU ALORS+ ne dérange pas le transfert du H+.
Cependant, bien que l'eau soit présente dans HBr (aq), son comportement est finalement similaire à celui d'une molécule H-Br; c'est-à-dire un H+ est transféré de HBr ou Br-H3OU ALORS+.
Proprietes physiques et chimiques
Formule moléculaire
HBr.
Poids moléculaire
80,972 g / mol. Notez que, comme mentionné dans la section précédente, seul le HBr est pris en compte et non la molécule d'eau. Si le poids moléculaire était tiré de la formule Br-H3OU ALORS+ aurait une valeur d'environ 99 g / mol.
Apparence physique
Liquide incolore ou jaune pâle, qui dépendra de la concentration du HBr dissous. Plus il est jaune, plus il sera concentré et dangereux.
Odeur
Piquant, irritant.
Seuil d'odeur
6,67 mg / m3.
Densité
1,49 g / cm3 (Solution aqueuse à 48% p / p). Cette valeur, ainsi que celles correspondant aux points de fusion et d'ébullition, dépendent de la quantité de HBr dissous dans l'eau..
Point de fusion
-11 ° C (12 ° F, 393 ° K) (solution aqueuse à 49% p / p).
Point d'ébullition
122 ºC (252 ºF. 393 ºK) à 700 mmHg (solution aqueuse 47-49% p / p).
Solubilité dans l'eau
-221 g / 100 ml (à 0 ° C).
-204 g / 100 ml (15 ºC).
-130 g / 100 ml (100 ºC).
Ces valeurs se réfèrent au HBr gazeux et non à l'acide bromhydrique. Comme on peut le voir, à mesure que la température augmente, la solubilité du HBr diminue; comportement naturel des gaz. Par conséquent, si des solutions concentrées de HBr (aq) sont nécessaires, il est préférable de travailler avec elles à basse température..
Si vous travaillez à des températures élevées, le HBr s'échappera sous forme de molécules diatomiques gazeuses, le réacteur doit donc être scellé pour éviter sa fuite..
Densité de vapeur
2,71 (par rapport à l'air = 1).
Acidité pKa
-9.0. Cette constante négative indique sa grande force d'acidité..
Capacité calorique
29,1 kJ / mol.
Enthalpie molaire standard
198,7 kJ / mol (298 ºK).
Entropie molaire standard
-36,3 kJ / mol.
point d'allumage
Non inflammable.
Nomenclature
Son nom «acide bromhydrique» combine deux faits: la présence d'eau, et ce brome a une valence de -1 dans le composé. En anglais, c'est un peu plus évident: l'acide bromhydrique, où le préfixe «hydro» (ou hydro) fait référence à l'eau; même si, en fait, il peut également se référer à l'hydrogène.
Le brome a une valence de -1 car il est lié à un atome d'hydrogène moins électronégatif que lui; mais s'il était lié ou interagissant avec des atomes d'oxygène, il peut avoir de nombreuses valences, telles que: +2, +3, +5 et +7. Avec le H, il ne peut adopter qu'une seule valence, et c'est pourquoi le suffixe -ico est ajouté à son nom.
Alors que HBr (g), le bromure d'hydrogène, est anhydre; c'est-à-dire qu'il n'a pas d'eau. Par conséquent, il est nommé sous d'autres normes de nomenclature, correspondant à celle des halogénures d'hydrogène..
Comment se forme-t-il?
Il existe plusieurs méthodes de synthèse pour préparer l'acide bromhydrique. Certains d'entre eux sont:
Mélange d'hydrogène et de brome dans l'eau
Sans décrire les détails techniques, cet acide peut être obtenu à partir du mélange direct d'hydrogène et de brome dans un réacteur rempli d'eau..
Hdeux + Brdeux => HBr
De cette manière, au fur et à mesure que le HBr se forme, il se dissout dans l'eau; cela peut l'entraîner dans les distillations, de sorte que des solutions avec des concentrations différentes peuvent être extraites. L'hydrogène est un gaz et le brome est un liquide rougeâtre foncé.
Tribromure de phosphore
Dans un processus plus élaboré, du sable, du phosphore rouge hydraté et du brome sont mélangés. Des pièges à eau sont placés dans des bains de glace pour empêcher le HBr de s'échapper et de former à la place de l'acide bromhydrique. Les réactions sont:
2P + 3Brdeux => 2PBr3
PBr3 + 3HdeuxO => 3HBr + H3PO3
Dioxyde de soufre et brome
Une autre façon de le préparer est de faire réagir le brome avec du dioxyde de soufre dans l'eau:
Brdeux + SWdeux + 2HdeuxO => 2HBr + HdeuxSW4
C'est une réaction redox. Le BRdeux il réduit, gagne des électrons, en se liant à des hydrogènes; tandis que le SOdeux s'oxyde, perd des électrons, lorsqu'il forme plus de liaisons covalentes avec d'autres oxygènes, comme dans l'acide sulfurique.
Applications
Préparation du bromure
Les sels de bromure peuvent être préparés en faisant réagir HBr (aq) avec un hydroxyde métallique. Par exemple, la production de bromure de calcium est considérée:
Ca (OH)deux + 2HBr => CaBrdeux + HdeuxOU ALORS
Un autre exemple concerne le bromure de sodium:
NaOH + HBr => NaBr + HdeuxOU ALORS
Ainsi, de nombreux bromures inorganiques peuvent être préparés.
Synthèse d'halogénures d'alkyle
Et qu'en est-il des bromures organiques? Ce sont des composés organobromés: RBr ou ArBr.
Déshydratation alcoolique
La matière première pour les obtenir peut être des alcools. Lorsqu'ils sont protonés par l'acidité de HBr, ils forment de l'eau, qui est un bon groupe partant, et à sa place est incorporé l'atome de Br volumineux, qui deviendra lié par covalence avec du carbone:
ROH + HBr => RBr + HdeuxOU ALORS
Cette déshydratation est réalisée à des températures supérieures à 100 ° C, dans le but de faciliter la rupture de la liaison R-OH.deux+.
Ajout aux alcènes et alcynes
La molécule HBr peut être ajoutée à partir de sa solution aqueuse à la double ou triple liaison d'un alcène ou d'un alcyne:
RdeuxC = CRdeux + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Plusieurs produits peuvent être obtenus, mais dans des conditions simples, le produit se forme principalement là où le brome est lié à un carbone secondaire, tertiaire ou quaternaire (règle de Markovnikov).
Ces halogénures sont impliqués dans la synthèse d'autres composés organiques et leur gamme d'utilisations est très étendue. De même, certains d'entre eux peuvent même être utilisés dans la synthèse ou la conception de nouveaux médicaments..
Clivage de l'éther
A partir des éthers, deux halogénures d'alkyle peuvent être obtenus simultanément, chacun portant l'une des deux chaînes latérales R ou R 'de l'éther initial R-O-R'. Quelque chose de similaire à la déshydratation des alcools se produit, mais leur mécanisme de réaction est différent.
La réaction peut être décrite avec l'équation chimique suivante:
ROR '+ 2HBr => RBr + R'Br
Et l'eau est également libérée.
Catalyseur
Son acidité est telle qu'il peut être utilisé comme catalyseur acide efficace. Au lieu d'ajouter l'anion Br- à la structure moléculaire, cède la place à une autre molécule pour le faire.
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Steven A. Hardinger. (2017). Glossaire illustré de chimie organique: acide bromhydrique. Récupéré de: chem.ucla.edu
- Wikipédia. (2018). Acide bromhydrique. Récupéré de: en.wikipedia.org
- PubChem. (2018). Acide bromhydrique. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Institut national de sécurité et d'hygiène au travail. (2011). Bromure d'hydrogène. [PDF]. Récupéré de: insht.es
- PrepChem. (2016). Préparation d'acide bromhydrique. Récupéré de: prepchem.com



Personne n'a encore commenté ce post.