
Structure moléculaire du cyanure d'hydrogène, propriétés, utilisations
le acide cyanhydrique ou le cyanure d'hydrogène est un composé organique dont la formule chimique est HCN. Il est également connu sous le nom de méthanonitrile ou formonitrile et, jusqu'à il y a plusieurs années, sous le nom d'acide prussique, bien qu'il s'agisse en fait d'un autre composé.
L'acide cyanhydrique est un gaz extrêmement toxique et incolore obtenu en traitant les cyanures avec des acides. Cet acide se trouve à l'intérieur de la graine de pêches, également connue dans de nombreux endroits sous le nom de pêches..

À une température ambiante inférieure à 25 ºC, c'est un liquide et au-dessus de cette température, c'est un gaz. Dans les deux cas, il est extrêmement toxique pour les humains, les animaux et même la plupart des micro-organismes qui n'y sont pas acclimatés. C'est un bon solvant pour les ions. Il est très instable car il a tendance à polymériser facilement.
On le trouve dans le règne végétal incorporé dans les molécules de certains glycosides, car lorsque ceux-ci sont hydrolysés par les enzymes de la plante, on obtient HCN, glucose et benzaldéhyde..
Ces glycosides se trouvent dans les graines de certains fruits tels que les pêches, les abricots, les cerises, les prunes et les amandes amères, ils ne doivent donc jamais être ingérés..
On le trouve également dans les glycosides végétaux tels que certains types de sorgho. De plus, certaines bactéries le produisent au cours de leur métabolisme. Il est principalement utilisé dans la production de polymères et dans certains procédés métallurgiques.
Le HCN est un poison mortel par inhalation, ingestion et contact. Il est présent dans la fumée de cigarette et dans la fumée des incendies de plastiques et de matériaux contenant du carbone et de l'azote. Il est considéré comme un polluant atmosphérique car il est produit lors de la combustion de matières organiques provenant de grandes zones de la planète.
Index des articles
- 1 Structure moléculaire et configuration électronique
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Point d'ébullition
- 3.5 Point d'éclair
- 3.6 Température d'auto-inflammation
- 3.7 Densité
- 3.8 Solubilité
- 3.9 Constante de dissociation
- 3.10 Certaines propriétés chimiques
- 3.11 Corrosivité
- 4 Situation dans la nature
- 5 utilisations
- 5.1 Lors de la préparation d'autres composés chimiques et polymères
- 5.2 Utilisations diverses
- 5.3 Dans l'agriculture
- 6 risques
- 6.1 Mécanisme d'action létale dans le corps
- 6.2 Risque de fumée de cigarette
- 6.3 Risques de chauffage HCN
- 6.4 Présence de HCN dans la fumée d'incendie
- 6.5 Polluant atmosphérique
- 7 Références
Structure moléculaire et configuration électronique
L'acide cyanhydrique ou cyanure d'hydrogène est un composé moléculaire covalent avec un atome d'hydrogène, un atome de carbone et un atome d'azote..
L'atome de carbone et l'atome d'azote partagent 3 paires d'électrons, ils forment donc une triple liaison. L'hydrogène est lié au carbone, qui avec cette liaison présente sa valence de quatre et son octet d'électrons complet.
L'azote a une valence de cinq et pour compléter son octet, il a une paire d'électrons non appariés ou solitaires situés latéralement.
Le HCN est donc une molécule complètement linéaire, avec une paire d'électrons non appariée située latéralement dans l'azote..
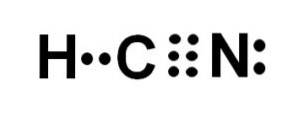
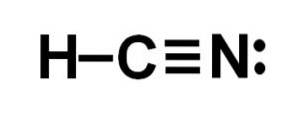
Nomenclature
- Acide cyanhydrique
- Cyanure d'hydrogène
- Méthanonitrile
- Formonitrile
- Acide cyanhydrique
Propriétés
État physique
En dessous de 25,6 ºC, s'il est anhydre et stabilisé, il s'agit d'un liquide incolore ou bleu pâle très instable et toxique. S'il est au-dessus de cette température, c'est un gaz incolore extrêmement toxique.
Poids moléculaire
27,03 g / mol
Point de fusion
-13,28 ºC
Point d'ébullition
25,63 ºC (notez qu'il bout juste au-dessus de la température ambiante).
Point d'inflammation
-18 ºC (méthode en coupe fermée)
La température d'auto-inflammation
538 ºC
Densité
0,6875 g / cm3 à 20 ºC
Solubilité
Entièrement miscible à l'eau, à l'alcool éthylique et à l'éther éthylique.
Constante de dissociation
K = 2,1 x 10-9
paquetà = 9,2 (c'est un acide très faible)
Quelques propriétés chimiques
Le HCN a une constante diélectrique très élevée (107 à 25 ºC). En effet, ses molécules sont très polaires et s'associent par des liaisons hydrogène, comme dans le cas de l'eau HdeuxOU ALORS.
En raison de sa constante diélectrique élevée, le HCN s'avère être un bon solvant ionisant..
Le HCN liquide anhydre est très instable, il a tendance à polymériser violemment. Pour éviter cela, des stabilisants sont ajoutés, comme un petit pourcentage de HdeuxSW4.
En solution aqueuse et en présence d'ammoniaque et sous haute pression, il forme l'adénine, un composé qui fait partie de l'ADN et de l'ARN, c'est-à-dire une molécule biologiquement importante.
C'est un acide très faible, car sa constante d'ionisation est très petite, donc il ne s'ionise que partiellement dans l'eau, donnant l'anion cyanure CN-. Forme des sels avec des bases mais pas avec des carbonates.
Ses solutions aqueuses non protégées de la lumière se décomposent lentement en générant du formiate d'ammonium HCOONH4.
En solution, il a une légère odeur d'amande.
Corrosivité
Comme il s'agit d'un acide faible, il n'est généralement pas corrosif.
Cependant, les solutions aqueuses de HCN contenant de l'acide sulfurique comme stabilisant attaquent fortement l'acier à des températures supérieures à 40 ºC et l'acier inoxydable à des températures supérieures à 80 ºC..
De plus, les solutions aqueuses diluées de HCN peuvent provoquer une contrainte sur l'acier au carbone même à température ambiante..
Il peut également attaquer certains types de caoutchoucs, plastiques et revêtements.
Emplacement dans la nature
On le trouve relativement abondant dans le règne végétal dans le cadre des glycosides.
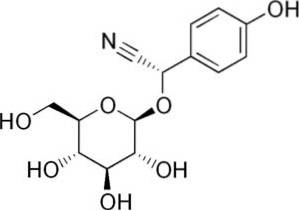
Par exemple, il est généré à partir de l'amygdaline C6H5-CH (-CN) -O-Glucose-O-Glucose, un composé présent dans les amandes amères. L'amygdaline est un bêta-glucoside cyanogène, car lorsqu'il est hydrolysé, il forme deux molécules de glucose, une de benzaldéhyde et une de HCN. L'enzyme qui les libère est la bêta-glucoxydase.
L'amygdaline se trouve dans les graines de pêches, d'abricots, d'amandes amères, de cerises et de prunes..
Certains types de plantes de sorgho contiennent le glycoside cyanogène durrin (c.-à-d. P-hydroxy- (S) -mandélonitrile-bêta-D-glucoside). Ce composé peut être dégradé par une hydrolyse enzymatique en deux étapes.
Premièrement, l'enzyme durrinase qui est endogène dans les plantes de sorgho l'hydrolyse en glucose et p-hydroxy- (S) -mandélonitrile. Ce dernier est ensuite rapidement converti en HCN libre et en p-hydroxybenzaldéhyde.

Le HCN est responsable de la résistance des plants de sorgho aux ravageurs et pathogènes.
Cela s'explique par le fait que la durrine et l'enzyme durrinase ont des emplacements différents dans ces plantes et qu'elles n'entrent en contact que lorsque les tissus sont endommagés ou détruits, libérant le HCN et protégeant la plante des infections qui pourraient pénétrer à travers la partie lésée..
De plus, certaines bactéries pathogènes humaines telles que Pseudomonas aeruginosa Oui P. gingivalis ils le produisent au cours de leur activité métabolique.
Applications
Dans la préparation d'autres composés chimiques et polymères
L'utilisation qui implique la plupart du HCN produit au niveau industriel est la préparation d'intermédiaires pour la synthèse organique..
Il est utilisé dans la synthèse de l'adiponitrile NC- (CHdeux)4-CN, qui est utilisé pour fabriquer du nylon, ou du nylon, un polyamide. Il est également utilisé pour préparer l'acrylonitrile ou le cyanoéthylène CHdeux= CH-CN, utilisé pour préparer les fibres acryliques et les plastiques.
Son dérivé cyanure de sodium NaCN est utilisé pour la récupération de l'or dans l'extraction de ce métal.
Un autre de ses dérivés, le chlorure de cyanogène ClCN, est utilisé pour les formules pesticides.
HCN est utilisé pour la préparation d'agents chélateurs tels que l'EDTA (éthylène-diamine-tétra-acétate).
Il est utilisé pour la fabrication de ferrocyanures et de certains produits pharmaceutiques.
Divers usages
Le gaz HCN a été utilisé comme insecticide, fongicide et désinfectant pour la fumigation des navires et des bâtiments. Aussi pour fumiger les meubles afin de les restaurer.
Le HCN a été utilisé dans le polissage des métaux, la galvanoplastie des métaux, les procédés photographiques et les procédés métallurgiques..
En raison de sa forte toxicité, il a été désigné comme agent de guerre chimique..
En agriculture
Il a été utilisé comme herbicide et pesticide dans les vergers. Il a été utilisé pour contrôler les écailles et autres agents pathogènes sur les agrumes, mais certains de ces ravageurs sont devenus résistants au HCN..
Il a également été utilisé pour fumiger les silos à grains. Le gaz HCN préparé sur place a été utilisé dans la fumigation des grains de blé pour les préserver des parasites tels que les insectes, les champignons et les rongeurs. Pour cette utilisation, il est essentiel que les graines à fumiger tolèrent l'agent pesticide..
Des tests ont été effectués en pulvérisant des semences de blé avec du HCN et il a été constaté que cela n'affectait pas négativement leur potentiel de germination, mais semble plutôt le favoriser..
Cependant, des doses élevées de HCN peuvent réduire considérablement la longueur des petites feuilles qui poussent à partir de la graine..
D'autre part, en raison du fait qu'il s'agit d'un nématicide puissant et que certaines plantes de sorgho en ont dans leurs tissus, le potentiel des plantes de sorgho à être utilisé comme engrais vert biocide est à l'étude..
Son utilisation servirait à améliorer les sols, à supprimer les mauvaises herbes et à contrôler les maladies et les dommages causés par les nématodes phytoparasites..
Des risques
Pour l'homme, le HCN est un poison mortel par toutes les voies: inhalation, ingestion et contact..

L'inhalation peut être mortelle. On estime qu'environ 60 à 70% de la population peut détecter l'odeur d'amande amère du HCN lorsqu'il est dans l'air à une concentration de 1 à 5 ppm..
Mais il y a 20% de la population qui ne peut pas le détecter même à des concentrations létales parce qu'ils sont génétiquement incapables de le faire.
Ingéré, c'est un poison aigu et à action immédiate..
Si leurs solutions entrent en contact avec la peau, le cyanure associé peut être mortel.
Le HCN est présent dans la fumée de cigarette et celui généré lorsque des plastiques contenant de l'azote sont brûlés.
Mécanisme d'action mortel dans le corps
C'est un asphyxiateur chimique et est rapidement toxique, entraînant fréquemment la mort. En entrant dans le corps, il se lie aux métalloenzymes (enzymes qui contiennent un ion métallique), les inactivant. C'est un agent toxique pour divers organes du corps humain
Son principal effet toxique consiste en l'inhibition de la respiration cellulaire, car il désactive une enzyme qui influence la phosphorylation dans les mitochondries, qui sont des organites qui interviennent, entre autres, dans la fonction respiratoire des cellules..
Risque de fumée de cigarette
HCN est présent dans la fumée de cigarette.
Bien que de nombreuses personnes connaissent l'effet d'empoisonnement du HCN, peu de personnes se rendent compte qu'elles sont exposées à ses effets nocifs par la fumée de cigarette..
Le HCN est l'une des causes de l'inhibition de plusieurs enzymes respiratoires cellulaires. La quantité de HCN présente dans la fumée de cigarette a un effet particulièrement néfaste sur le système nerveux..
Des niveaux de HCN dans la fumée de cigarette ont été rapportés entre 10 et 400 μg par cigarette pour la fumée directement inhalée et de 0,006 à 0,27 μg / cigarette pour l'inhalation secondaire (fumée secondaire). HCN produit des effets toxiques à partir de 40 μM.

Lorsqu'il est inhalé, il pénètre rapidement dans la circulation sanguine, où il est libéré dans le plasma ou se lie à l'hémoglobine. Une petite partie est convertie en thiocyanate et est excrétée dans l'urine.
Risques de chauffage HCN
Une exposition prolongée à la chaleur du HCN liquide dans des récipients fermés peut provoquer une rupture violente inattendue des récipients. Peut polymériser de manière explosive à 50-60 ° C en présence de traces d'alcali et en l'absence d'inhibiteurs.
Présence de HCN dans la fumée des incendies
Le HCN est libéré lors de la combustion de polymères contenant de l'azote, tels que la laine, la soie, les polyacrylonitriles et le nylon, entre autres. Ces matériaux sont présents dans nos maisons et dans la plupart des lieux d'activité humaine.
Pour cette raison, pendant les incendies, le HCN peut potentiellement être la cause de la mort par inhalation..
Polluant de l'atmosphère
Le HCN est un polluant de la troposphère. Il résiste à la photolyse et dans les conditions ambiantes de l'atmosphère, il ne subit pas d'hydrolyse.
Les radicaux hydroxyle OH • produits photochimiquement peuvent réagir avec le HCN, mais la réaction est très lente, de sorte que la demi-vie du HCN dans l'atmosphère est de 2 ans.
Lorsque la biomasse, en particulier la tourbe, est brûlée, le HCN est rejeté dans l'atmosphère, ainsi que lors des activités industrielles. Cependant, la combustion de la tourbe est 5 à 10 fois plus polluante que la combustion d'autres types de biomasse.
Certains chercheurs ont découvert que les températures élevées et la sécheresse causées par le phénomène El Niño dans certaines zones de la planète exacerbent les incendies saisonniers dans les zones à forte teneur en matière végétale décomposée..

Cela conduit à une combustion intense de la biomasse pendant les saisons sèches..
Ces événements sont à l'origine de fortes concentrations de HCN dans la troposphère, qui finissent par être transportées vers la basse stratosphère et restent très longtemps..
Les références
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- NOUS. Bibliothèque nationale de médecine. (2019). Cyanure d'hydrogène. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Cyanure d'hydrogène - une mise à jour. Médecine du travail 2017; 67: 662-663. Récupéré de ncbi.nlm.nih.gov.
- Encyclopédie scientifique de Van Nostrand. (2005). Cyanure d'hydrogène. 9e Récupéré de onlinelibrary.wiley.com.
- Ren, Y.-L. et coll. (mille neuf cent quatre vingt seize). Effet du cyanure d'hydrogène et du sulfure de carbonyle sur la germination et la vigueur des plumules du blé. Pesticide. Sei.1996, 47, 1-5. Récupéré de onlinelibrary.wiley.com.
- De Nicola, G.R. et coll. (2011). Une méthode analytique simple pour l'évaluation de la teneur en dhurrine dans les plantes cyanogéniques pour leur utilisation dans le fourrage et la biofumigation. J. Agric. Food Chem.2011, 59, 8065-8069. Récupéré de pubs.acs.org.
- Sheese, P.E. et coll. (2017). Une amélioration globale du cyanure d'hydrogène dans la basse stratosphère tout au long de 2016. Geophys. Res. Lett., 44, 5791-5797. Récupéré de agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. et Drochioiu, G. (2013). Visualisation du danger de fumer: une simple détermination spectrophotométrique du cyanure d'hydrogène dans la fumée de cigarette et les filtres. J. Chem. Educ.2013, 90, 1654-1657. Récupéré de pubs.acs.org.
- Alarie, Y. et coll. (1990). Rôle du cyanure d'hydrogène dans les décès humains par incendie. Dans le feu et les polymères. Chapitre 3. Série de symposiums de l'ACS. Récupéré de pubs.acs.org.


Personne n'a encore commenté ce post.