
Structure de l'acide chromique, propriétés, production, utilisations

le acide chromique ou HdeuxCrO4 c'est théoriquement l'acide associé à l'oxyde de chrome (VI) ou à l'oxyde de chrome CrO3. Ce nom est dû au fait que l'espèce HdeuxCrO4 est présent avec d'autres espèces de chrome (VI).
Oxyde chromique CrO3 il est également appelé acide chromique anhydre. Le CrO3 est un solide brun rougeâtre ou violet obtenu par traitement de solutions de dichromate de potassium KdeuxCrdeuxOU ALORS7 avec de l'acide sulfurique HdeuxSW4.

Les solutions aqueuses d'oxyde chromique subissent un équilibre de certaines espèces chimiques dont la concentration dépend du pH de la solution. Au pH basique, les ions chromate CrO prédominent4deux-, tandis qu'à pH acide, les ions HCrO prédominent4- et Cr bichromatedeuxOU ALORS7deux-. On estime qu'à pH acide, l'acide chromique H est également présentdeuxCrO4.
En raison de leur grand pouvoir oxydant, les solutions d'acide chromique sont utilisées en chimie organique pour réaliser des réactions d'oxydation. Ils sont également utilisés dans les processus électrochimiques pour traiter les métaux de manière à les rendre résistants à la corrosion et à l'usure..
Certains matériaux polymères sont également traités avec de l'acide chromique pour améliorer leur adhérence aux métaux, peintures et autres substances..
Les solutions d'acide chromique sont très dangereuses pour les humains, la plupart des animaux et l'environnement. Pour cette raison, les déchets liquides ou solides des procédés utilisant de l'acide chromique sont traités pour éliminer les traces de chrome (VI) ou pour récupérer tout le chrome présent et régénérer l'acide chromique en vue de sa réutilisation..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3.6 Autres propriétés
- 4 Chimie des solutions aqueuses en présence d'acide chromique
- 5 Obtention
- 6 utilisations de l'acide chromique
- 6.1 Dans l'oxydation de composés chimiques
- 6.2 Dans les procédés d'anodisation des métaux
- 6.3 Dans les traitements de conversion chimique
- 6.4 Dans les surfaces érodées ou piquées
- 6.5 Dans diverses utilisations
- 7 Récupération d'acide chromique
- 7.1 En utilisant des résines
- 7.2 Par régénération électrochimique
- 8 Utilisation de micro-organismes pour nettoyer les effluents avec des traces d'acide chromique
- 9 Risques de l'acide chromique et de l'oxyde chromique
- 10 Références
Structure
Molécule d'acide chromique HdeuxCrO4 il est formé par un ion chromate CrO4deux- et deux ions hydrogène H+ attaché à cela. Dans l'ion chromate, l'élément Chrome est dans un état d'oxydation de +6.
La structure spatiale de l'ion chromate est tétraédrique, où le chrome est au centre et les oxygènes occupent les quatre sommets du tétraèdre..
Dans l'acide chromique, les atomes d'hydrogène sont chacun avec un oxygène. Des quatre liaisons du chrome avec les atomes d'oxygène, deux sont doubles et deux sont simples, car ils ont les hydrogènes qui leur sont attachés.
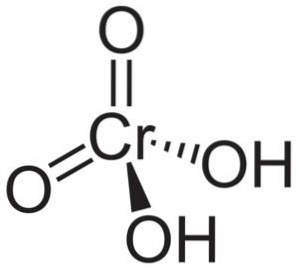
D'autre part, l'oxyde chromique CrO3 a un atome de chrome à l'état d'oxydation +6 entouré de seulement trois atomes d'oxygène.
Nomenclature
- Acide chromique HdeuxCrO4
- Acide tétraoxochromique HdeuxCrO4
- Oxyde chromique (acide chromique anhydre) CrO3
- Trioxyde de chrome (acide chromique anhydre) CrO3
Propriétés
État physique
L'acide chromique anhydre ou l'oxyde chromique est un solide cristallin violet à rouge
Poids moléculaire
CrO3: 118,01 g / mol
Point de fusion
CrO3: 196 ºC
Au-dessus de son point de fusion, il est thermiquement instable, il perd de l'oxygène (est réduit) pour donner de l'oxyde de chrome (III) CrdeuxOU ALORS3. Il se décompose à environ 250 ºC.
Densité
CrO3: 1,67 à 2,82 g / cm3
Solubilité
Le CrO3 il est très soluble dans l'eau: 169 g / 100 g d'eau à 25 ºC.
Il est soluble dans les acides minéraux tels que le sulfurique et le nitrique. Soluble dans l'alcool.
Autres propriétés
Le CrO3 il est très hygroscopique, ses cristaux sont déliquescents.
Quand le CrO3 se dissout dans l'eau forme des solutions fortement acides.
C'est un oxydant très puissant. Oxyde vigoureusement la matière organique sous presque toutes ses formes. Attaque le tissu, le cuir et certains plastiques. Attaque également la plupart des métaux.
Il est fortement toxique et très irritant en raison de son potentiel oxydant élevé..
Chimie des solutions aqueuses en présence d'acide chromique
Oxyde chromique CrO3 se dissout rapidement dans l'eau. En solution aqueuse, le chrome (VI) peut exister sous différentes formes ioniques.
À pH> 6,5 ou en solution alcaline, le chrome (VI) acquiert l'ion chromate sous forme CrO4deux- jaune.
Si le pH est abaissé (1 < pH < 6,5) el cromo (VI) forma principalmente el ion HCrO4- , qui peut se dimériser en ion bichromate CrdeuxOU ALORS7deux-, et la solution vire à l'orange. À un pH compris entre 2,5 et 5,5, les espèces prédominantes sont HCrO4- et CRdeuxOU ALORS7deux-.

Les équilibres qui se produisent dans ces solutions lorsque le pH diminue sont les suivants:
CrO4deux- (ion chromate) + H+ ⇔ HCrO4-
HCrO4- + H+ ⇔ HdeuxCrO4 (acide chromique)
2HCrO4- ⇔ CrdeuxOU ALORS7deux- (ion bichromate) + HdeuxOU ALORS
Ces équilibres ne se produisent que si l'acide ajouté pour abaisser le pH est HNO3 ou HClO4, car avec d'autres acides différents composés se forment.
Les solutions acides de bichromate sont des agents oxydants très puissants. Mais dans les solutions alcalines, l'ion chromate est beaucoup moins oxydant.
Obtention
Selon les sources consultées, l'un des moyens d'obtenir de l'oxyde chromique CrO3, Cela consiste à ajouter de l'acide sulfurique à une solution aqueuse de bichromate de sodium ou de potassium, formant un précipité rouge-orange..

Acide chromique HdeuxCrO4 Il se trouve dans des solutions aqueuses d'oxyde chromique en milieu acide.
Utilisations d'acide chromique
Dans l'oxydation de composés chimiques
En raison de sa capacité fortement oxydante, l'acide chromique a longtemps été utilisé avec succès pour oxyder des composés organiques et inorganiques..
Parmi d'innombrables exemples sont les suivants: il permet d'oxyder les alcools primaires en aldéhydes et ceux-ci en acides carboxyliques, les alcools secondaires en cétones, le toluène en acide benzoïque, l'éthylbenzène en acétophénone, le triphénylméthane en triphénylcarbinol, l'acide formique en COdeux, acide oxalique en COdeux, acide lactique en acétaldéhyde et COdeux, ion ferreux Fedeux+ à l'ion ferrique Fe3+, ion iodure en iode, etc..
Il permet la conversion des nitroso-composés en nitro-composés, des sulfures en sulfones. Il est impliqué dans la synthèse des cétones à partir d'alcènes, car il oxyde les alcènes hydroborés en cétones.
Composés hautement résistants aux oxydants courants, tels que l'oxygène Odeux ou peroxyde d'hydrogène HdeuxOU ALORSdeux, ils sont oxydés par l'acide chromique. C'est le cas de certains boranes hétérocycliques.
Dans les processus d'anodisation des métaux
L'anodisation à l'acide chromique est un traitement électrochimique appliqué à l'aluminium pour le protéger pendant de nombreuses années de l'oxydation, de la corrosion et de l'usure..
Le processus d'anodisation implique la formation électrochimique d'une couche d'oxyde d'aluminium ou d'alumine sur le métal. Cette couche est ensuite scellée dans de l'eau chaude, avec laquelle la conversion en oxyde d'aluminium trihydraté est réalisée..
La couche d'oxyde scellée est épaisse, mais structurellement faible et peu satisfaisante pour le collage ultérieur. Cependant, l'ajout d'une petite quantité d'acide chromique à l'eau de scellement développe une surface qui peut former de bonnes liaisons..
L'acide chromique dans l'eau de scellement dissout une partie de la structure grossière en forme de cellule et laisse une couche mince, solide et fermement attachée d'oxyde d'aluminium, à laquelle les adhésifs adhèrent et forment des liaisons solides et durables..
L'anodisation à l'acide chromique s'applique également au titane et à ses alliages.
Dans les traitements de conversion chimique
L'acide chromique est utilisé dans les procédés de revêtement métallique par conversion chimique.
Au cours de ce processus, les métaux sont immergés dans des solutions d'acide chromique. Cela réagit et dissout partiellement la surface tout en déposant une fine couche de composés complexes de chrome qui interagissent avec le métal de base..
Ce processus est appelé revêtement de conversion au chromate ou chromage de conversion..
Les métaux généralement soumis au chromage de conversion sont différents types d'acier, tels que l'acier au carbone, l'acier inoxydable et l'acier zingué, et divers métaux non ferreux, tels que les alliages de magnésium, les alliages d'étain, les alliages d'aluminium, le cuivre. , cadmium, manganèse et argent.
Ce traitement offre une résistance à la corrosion et une brillance au métal. Plus le pH du procédé est élevé, plus la résistance à la corrosion est élevée. La température accélère la réaction acide.
Des revêtements de différentes couleurs peuvent être appliqués, tels que le bleu, le noir, l'or, le jaune et le transparent. Il offre également une meilleure adhérence de la surface métallique aux peintures et adhésifs.
Dans les surfaces érodées ou piquées
Les solutions d'acide chromique sont utilisées dans la préparation de la surface d'objets en matériau thermoplastique, en polymères thermodurcis et en élastomères pour leur revêtement ultérieur avec des peintures ou des adhésifs..
Le HdeuxCrO4 il a un effet sur la chimie de la surface et sa structure, car il contribue à augmenter sa rugosité. La combinaison de piqûres et d'oxydation augmente la pénétration des adhésifs et peut même provoquer des changements dans les propriétés du polymère..
Il a été utilisé pour éroder le polyéthylène basse densité ramifié, le polyéthylène linéaire haute densité et le polypropylène.
Il est largement utilisé dans l'industrie de la galvanoplastie ou de la galvanoplastie pour faciliter l'adhésion métal-polymère.
Dans diverses utilisations
L'acide chromique est utilisé comme agent de préservation du bois, également dans les matériaux magnétiques et pour la catalyse des réactions chimiques.
Récupération d'acide chromique
Il existe de nombreux procédés qui utilisent de l'acide chromique et génèrent des flux ou des résidus contenant du chrome (III) qui ne peuvent pas être éliminés car ils contiennent des ions chrome (VI) très toxiques, et ils ne peuvent pas non plus être réutilisés car la concentration en ions chromate est très élevée. faible..
Leur élimination nécessite la réduction chimique des chromates en chrome (III), suivie de la précipitation de l'hydroxyde et de la filtration, ce qui génère des coûts supplémentaires.
Pour cette raison, diverses méthodes ont été étudiées pour éliminer et récupérer les chromates. En voici quelques-uns.
En utilisant des résines
Les résines échangeuses d'ions sont utilisées depuis de nombreuses années pour le traitement des eaux contaminées par les chromates. C'est l'un des traitements approuvés par l'Agence américaine de protection de l'environnement, ou EPA. Agence de Protection de l'Environnement).
Cette méthode permet la récupération de l'acide chromique concentré car il est à nouveau régénéré à partir de la résine..
Les résines peuvent être à base forte ou faible. Dans les résines fortement basiques, le chromate peut être éliminé car les ions HCrO4- et CRdeuxOU ALORS7deux- sont échangés avec des ions OH- et Cl-. Dans les résines faiblement basiques, par exemple les résines sulfate, les ions sont échangés avec du SO4deux-.
Dans le cas des résines R- (OH) fortement basiques, les réactions globales sont les suivantes:
2ROH + HCrO4- + H+ ⇔ RdeuxCrO4 + 2HdeuxOU ALORS
RdeuxCrO4 + 2HCrO4- ⇔ 2RHCrO4 + CrO4deux-
RdeuxCrO4 + HCrO4- + H+ ⇔ RdeuxCrdeuxOU ALORS7 + HdeuxOU ALORS
Pour chaque mole de RdeuxCrO4 convertie, une mole de Cr (VI) est éliminée de la solution, ce qui rend cette méthode très intéressante..
Après élimination des chromates, la résine est traitée avec une solution fortement alcaline pour les régénérer dans un endroit sûr. Ensuite, les chromates sont convertis en acide chromique concentré pour être réutilisés..
Par régénération électrochimique
Une autre méthode est la régénération électrochimique de l'acide chromique, qui est également une alternative très pratique. Par ce procédé, le chrome (III) est oxydé anodiquement en chrome (VI). Le matériau d'anode dans ces cas est de préférence du dioxyde de plomb..
Utilisation de micro-organismes pour nettoyer les effluents avec des traces d'acide chromique
Une méthode qui a été étudiée et qui est toujours à l'étude est l'utilisation de microorganismes naturellement présents dans certains effluents contaminés par des ions chrome hexavalent, qui sont ceux contenus dans les solutions d'acide chromique..

C'est le cas de certaines bactéries présentes dans les eaux usées de tannage du cuir. Ces microbes ont été étudiés et il a été déterminé qu'ils sont résistants aux chromates et sont également capables de réduire le chrome (VI) en chrome (III) qui est beaucoup moins nocif pour l'environnement et les êtres vivants..
Pour cette raison, on estime qu'ils peuvent être utilisés comme méthode respectueuse de l'environnement pour l'assainissement et la désintoxication des effluents contaminés par des traces d'acide chromique..
Risques liés à l'acide chromique et à l'oxyde chromique
Le CrO3 Il n'est pas combustible mais il peut intensifier la combustion d'autres substances. Beaucoup de leurs réactions peuvent provoquer un incendie ou une explosion.
Le CrO3 et les solutions d'acide chromique sont de puissants irritants pour la peau (peut provoquer une dermatite), les yeux (peut brûler) et les muqueuses (peut provoquer un bronchoasma) et peuvent provoquer des «trous de chrome» dans le système respiratoire.
Les composés du chrome (VI) tels que l'acide chromique et l'oxyde chromique sont gravement toxiques, mutagènes et cancérigènes pour la plupart des êtres vivants..
Les références
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- NOUS. Bibliothèque nationale de médecine. (2019). Acide chromique. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Wegman, R.F. et Van Twisk, J. (2013). Alliages d'aluminium et d'aluminium. 2.5. Processus d'anodisation à l'acide chromique. Dans les techniques de préparation de surface pour le collage par collage (deuxième édition). Récupéré de sciencedirect.com.
- Wegman, R.F. et Van Twisk, J. (2013). Magnésium. 6.4. Préparation d'alliages de magnésium et de magnésium par les procédés de traitement à l'acide chromique. Dans les techniques de préparation de surface pour le collage par collage (deuxième édition). Récupéré de sciencedirect.com.
- Grot, W. (2011). Applications. 5.1.8. Régénération d'acide chromique. Dans les ionomères fluorés (deuxième édition). Récupéré de sciencedirect.com.
- Swift, K.G. et Booker, J.D. (2013). Processus d'ingénierie de surface. 9.7. Chromant. Manuel de sélection des processus de fabrication. Récupéré de sciencedirect.com.
- Poulsson, A.H.C. et coll. (2019). Techniques de modification de surface du PEEK, y compris le traitement de surface au plasma. 11.3.2.1. Gravure de surface. In PEEK Biomaterials Handbook (deuxième édition). Récupéré de sciencedirect.com.
- Westheimer, F.H. (1949). Les mécanismes des oxydations de l'acide chromique. Chemical Reviews 1949, 45, 3, 419-451. Récupéré de pubs.acs.org.
- Tan, H.K.S. (1999). Élimination de l'acide chromique par échange d'anions. The Canadian Journal of Chemical Engineering, volume 77, février 1999. Récupéré de onlinelibrary.wiley.com.
- Kabir, M.M. et coll. (2018). Isolement et caractérisation des bactéries réduisant le chrome (VI) dans les effluents de tannerie et les déchets solides. Journal mondial de microbiologie et de biotechnologie (2018) 34: 126. Récupéré de ncbi.nlm.nih.gov.


Personne n'a encore commenté ce post.