
Synthèse d'acide phénoxyacétique, procédure, utilisations, risques

le acide phénoxyacétique C'est une substance de nature organique, formée par la réaction entre le phénol et l'acide monochloroacétique en présence d'une solution d'hydroxyde de sodium. La procédure utilisée pour obtenir ce produit s'appelle la synthèse des éthers de Williamson..
L'acide phénoxyacétique synthétisé est un précipité blanc ou incolore, formé de cristaux en forme d'aiguille, pratiquement insoluble dans l'eau (solubilité dans l'eau 12 g / l-1), mais soluble dans l'acide acétique, le phénol et l'éther diéthylique.
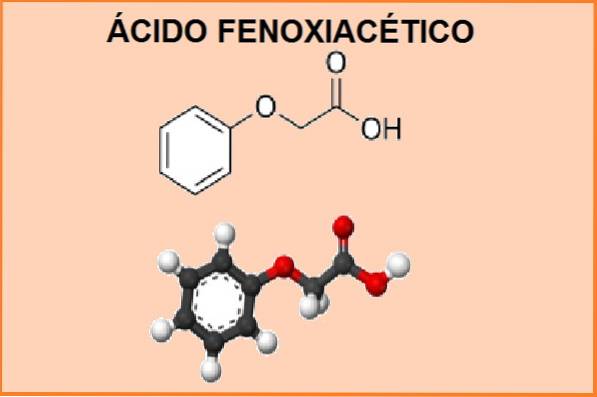
Son nom chimique est 2-phénoxyéthanoïque et sa formule moléculaire est C8 H8 OU ALORS3. La masse moléculaire est de 152,15 g.mol-1. Ce produit se comporte comme un acide faible et a un point de fusion compris entre 98 et 100 ° C et un point d'ébullition de 285 ° C.
L'acide phénoxyacétique est un produit intermédiaire dans la synthèse de substances aux propriétés herbicides. En soi, l'acide phénoxyacétique a des propriétés antifongiques contre Candida albicans et Trichophyton rubrum. Il est également utile comme exfoliant de la peau, éliminant l'excès de kératine dans les callosités.
Il est nécessaire de prendre des précautions pour sa manipulation car lorsqu'il est chauffé, il émet des gaz toxiques qui sont corrosifs. Parmi les gaz se trouve le chlorure d'hydrogène.
L'exposition directe avec ce produit peut provoquer une légère irritation de la peau ou des muqueuses, bien que pas d'une grande importance, sauf pour l'affectation de la muqueuse oculaire, elle peut être grave. Il provoque également une irritation des voies respiratoires en cas d'inhalation et des voies gastriques en cas d'ingestion..
C'est une substance ininflammable et assez stable à température ambiante, cependant, à des températures ou des pressions élevées, elle pourrait perdre sa stabilité, et face à l'eau, elle peut libérer une certaine quantité d'énergie, mais elle ne le fera pas violemment..
Index des articles
- 1 Synthèse de l'acide phénoxyacétique
- 2 Procédure
- 2.1 Étape 1
- 2.2 Étape 2
- 2.3 Étape 3
- 2.4 Étape 4
- 2.5 Étape 5
- 2.6 Étape 6
- 2.7 Étape 7
- 3 utilisations
- 4 risques
- 5 Précautions
- 6 Références
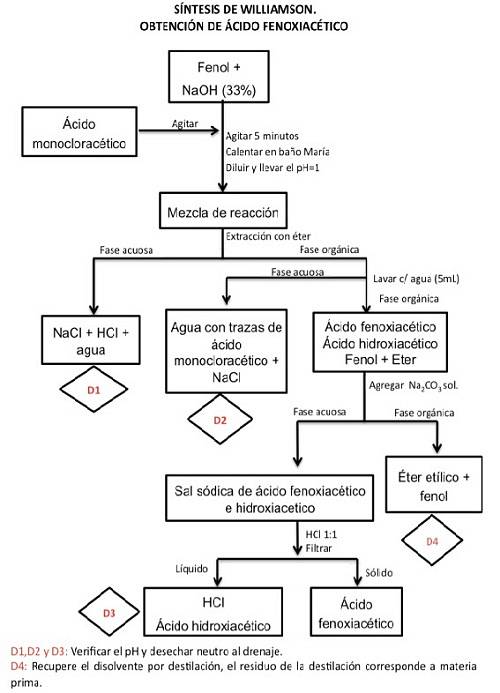
Synthèse de l'acide phénoxyacétique
Le phénol est un alcool et en tant que tel se comporte comme un acide faible, c'est pourquoi il perd facilement le proton acide (H+) contre un alcali (hydroxyde de sodium) pour devenir un alcoolate (phénolate). Ce dernier, par une substitution nucléophile bimoléculaire, formera de l'éther.
L'alcoxyde fonctionne comme un nucléophile, c'est-à-dire qu'il est capable de céder 2 électrons libres à une autre substance. Dans le cas de la réaction qui nous concerne, c'est l'halogénure d'alkyle (acide monochloroacétique), de telle sorte qu'il se lie fortement par des liaisons covalentes avec lui, formant une nouvelle substance qui dans ce cas est l'éther..
Au cours de la réaction, un déplacement de l'ion halogénure se produit, qui est remplacé par l'anion alcoxyde. Cette réaction est connue sous le nom de synthèse des éthers de Williamson..
La quantité de produit obtenu et la vitesse à laquelle il est produit dépendront de la concentration des réactifs impliqués, puisqu'il s'agit d'une réaction cinétique de second ordre, où la collision des molécules (nucléophile + halogénure d'alkyle) détermine son efficacité..
Traiter
Étape 1
Pour démarrer la synthèse de l'acide phénoxyacétique, 0,5 g de phénol est soigneusement pesé et placé dans un flacon à une bouche en forme de poire d'une capacité de 50 ml. 2,5 ml d'hydroxyde de sodium (NaOH) à 33% (p / v) sont ajoutés pour le dissoudre.
Vérifiez l'alcalinité de la solution avec un papier indicateur de pH. Placer un couvercle en liège sur le flacon et mélanger vigoureusement pendant 5 minutes. Un agitateur magnétique peut être utilisé pour mélanger.
Étape 2
Ensuite, ajoutez 0,75 g d'acide monochloroacétique et répétez la procédure de mélange pendant 5 minutes..
Si le mélange cherche à durcir ou à devenir pâteux, vous pouvez ajouter de l'eau (entre 1 à 3 ml), mais celle-ci s'ajoute petit à petit jusqu'à ce qu'elle revienne à la texture précédente, sans trop diluer.
Étape 3
Découvrez le flacon et placez-le dans un bain-marie avec un système de reflux pendant 10 minutes. Si le système de débit n'est pas disponible, laissez-le pendant 40 minutes.
Étape 4
Laisser refroidir la solution et ajouter 5 ml d'eau, puis acidifier avec une solution concentrée de HCl jusqu'à atteindre pH 1. (Mesurer le pH avec un papier à cet effet).
Étape 5
Passer le mélange soigneusement dans l'entonnoir de séparation et extraire trois fois, en utilisant 5 ml d'éther éthylique dans chaque procédure..
Mettre en commun les extraits organiques et remettre dans l'entonnoir de séparation pour exécuter un lavage à l'eau en trois exemplaires, en utilisant 5 ml d'eau pour chaque lavage..
Les fractions aqueuses sont séparées pour être jetées.
Étape 6
Ensuite, la fraction organique est extraite avec 3 ml de carbonate de sodium (NadeuxCO3) à 15% trois fois.
L'extrait aqueux alcalin obtenu est placé dans un bain de glace et acidifié par HCl jusqu'à pH = 1, ce qui engendre la précipitation du produit. L'étape d'acidification doit être effectuée très soigneusement en ajoutant goutte à goutte, car la réaction génère de la mousse et si elle est ajoutée brusquement elle pourrait éclabousser.
Le solide est obtenu par filtration sous vide, le précipité est lavé et laissé sécher.
Étape 7
Le produit obtenu est pesé et le rendement et la température de fusion sont observés..
Applications
L'acide phénoxyacétique seul a une activité fongicide contre certains champignons, tels que Candida albicans et Trichophyton rubrum. Cette action a été décrite dans une enquête menée par González et al..
Les travaux ont révélé que la concentration minimale inhibitrice ou fongistatique (CMI) et la concentration minimale fongicide (CMF) étaient les mêmes (2,5 mg / ml) pour 13 espèces de Candida albicans à partir d'échantillons cliniques, en particulier de patients atteints d'onychomycose.
Alors qu'une souche de Candida albicans L'ATCC 10231 avait une CMI de 2,5 mg / ml et une CMF de 5,0 mg / ml. Pour sa part, Trichophyton rubrum a présenté une CMI de 0,313 mg / ml et un CMF de 1,25 mg / ml dans 8 souches analysées à partir d'ongles infectés.
De plus, l'acide phénoxyacétique est très utile comme exfoliant de la kératine, il est donc capable de minimiser les callosités ou les boutons sur la peau affectée par ces caractéristiques.
D'autre part, l'acide phénoxyacétique est une matière première pour la synthèse de pesticides, en particulier d'herbicides, tels que Astix et Duplosan..
Des risques
Si le produit est ingéré accidentellement, il provoquera une irritation des muqueuses dans tout le tractus gastro-intestinal (bouche, œsophage, estomac et intestins)..
En cas d'inhalation, il provoquera une irritation de la muqueuse respiratoire, provoquant une insuffisance respiratoire et une toux..
Sur la peau, cela peut provoquer une légère irritation. Alors que sur la muqueuse oculaire, l'irritation sera plus sévère. Dans ces cas, il est recommandé de laver la zone touchée avec beaucoup d'eau et de savon et de laver abondamment la muqueuse oculaire à grande eau..
Ce produit a été associé comme facteur prédisposant à l'état ou à l'apparition de tumeurs adipeuses. Ces tumeurs se développent le plus souvent dans les extrémités ou l'abdomen.
En revanche, ce produit est classé comme non dangereux à transporter selon les critères décrits par les réglementations de transport.
Les pesticides dérivés de l'acide phénoxyacétique sont généralement toxiques pour l'environnement et ont été liés à des mutations génétiques, en particulier avec la translocation t présente dans le lymphome non hodgkinien chez l'homme..
Précautions
- Ce produit doit être tenu à l'écart des agents oxydants puissants et des bases avec lesquelles il peut réagir violemment..
- Il est important d'éviter de chauffer ce produit.
- Manipuler en utilisant des mesures de protection, telles que gants, blouse, lunettes de sécurité.
Les références
- González G, Trujillo R. Acide phénoxyacétique, identification et détermination de son action antifongique in vitro face à Candida albicans et Trichophyton rubrum. Révérend Peruana de la Faculté de pharmacie, 1998; 34 (109). Disponible en: unmsm.edu
- "Acide phénoxyacétique". Wikipedia, l'encyclopédie libre. 13 mai 2014 à 17h21 UTC. 13 mai 2014, 17:21 wikipedia.org
- Laboratoires Merck. Fiche de données de sécurité. 2017. Disponible sur: ens.uabc.mx/
- Laboratoires Aventis. Fiche de données de sécurité Aventis. 2001. Disponible sur: afipa.cl
- Gutiérrez M. Phénoxyacétique dans les urgences toxicologiques. Centre d'information et de conseils toxicologiques CIATOX. Université nationale de Colombie. Disponible sur: encolombia.com
- Sandoval M. (2015). Manuel des pratiques de laboratoire de chimie organique II. Faculté de chimie de l'Université nationale autonome du Mexique.
- Laboratoires Merck. Fiche de données de sécurité selon le règlement CE n ° 1907/2006. 2015 Disponible sur: ens.uabc.mx/
- Berzal-Cantalejo M, Herranz-Torrubiano A, Cuenca-González C.Tumeur adipeuse avec symptômes d'alarme. Rev Clín Med Fam 2015, 8 (3): 246-250. Disponible à: scielo.isciii.es/scielo.
- Matheus T, Bolaños A. Micronuclei: biomarqueur de génotoxicité chez les personnes exposées aux pesticides. Salus, 2014; 18 (2): 18-26. Disponible sur: ve.scielo.org



Personne n'a encore commenté ce post.