
Structure, propriétés, utilisations de l'acide phosphorique (H3PO4)

le acide phosphorique C'est un oxoacide de phosphore qui a la formule chimique H3PO4. Il se compose d'un acide minéral dans lequel trois protons acides sont liés à l'anion phosphate (PO43-). Bien qu'il ne soit pas considéré comme un acide fort, son utilisation incorrecte peut présenter un risque pour la santé.
Il peut être trouvé sous deux états: sous forme de solide sous forme de cristaux orthorhombiques épais, ou sous forme de liquide cristallin d'aspect sirupeux. Sa présentation commerciale la plus courante a une concentration de 85% p / p et une densité de 1,685 g / cm3. Cette densité vient de la main de la concentration.
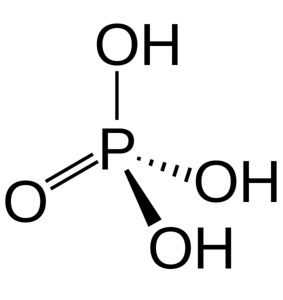
Les trois groupes OH sont responsables du don d'hydrogènes acides. En raison de leur présence dans sa structure, il peut réagir avec différents hydroxydes provenant de divers sels.
Dans le cas de l'hydroxyde de sodium, il peut en former trois: le phosphate de sodium monobasique (NaHdeuxPO4), phosphate de sodium dibasique (NadeuxHPO4) et phosphate de sodium tribasique (Na3PO4).
Cependant, en fonction de la base utilisée pour sa neutralisation, ou des cations qui en sont très proches, elle peut former d'autres sels de phosphate. Parmi eux, on trouve: le phosphate de calcium (Ca3(PO4)deux), phosphate de lithium (Li3PO4), phosphate ferrique (FePO4), et d'autres. Chacun avec ses différents degrés de protonation de l'anion phosphate.
D'autre part, l'acide phosphorique peut "séquestrer" des cations divalents tels que Fedeux+, Cudeux+, ACdeux+ et Mgdeux+. À des températures élevées, il peut réagir avec lui-même avec la perte d'une molécule HdeuxOu, formant des dimères, trimères et polymères d'acides phosphoriques.
Ce type de réaction rend ce composé capable d'établir un grand nombre de structures avec des squelettes de phosphore et d'oxygène, à partir desquelles une large gamme de sels appelés polyphosphates peut également être obtenue..
En ce qui concerne sa découverte, il a été synthétisé en 1694 par Robert Boyle, dissolvant PdeuxOU ALORS5 (pentoxyde de phosphore) dans l'eau. C'est l'un des acides minéraux les plus utiles, sa fonction d'engrais étant la plus importante. Le phosphore, avec le potassium et l'azote, constituent les trois principaux nutriments végétaux.
Index des articles
- 1 Structure chimique
- 1.1 Acide diphosphorique (H4P2O7)
- 1.2 Acides polyphosphoriques
- 1.3 Acides polyphosphoriques cycliques
- 2 Nomenclature
- 2.1 Ortho
- 2.2 Pyro
- 2.3 Objectif
- 3 propriétés
- 3.1 Formule moléculaire
- 3.2 Poids moléculaire
- 3.3 Apparence physique
- 3.4 Points d'ébullition et de fusion
- 3.5 Solubilité dans l'eau
- 3.6 Densité
- 3.7 Densité de vapeur
- 3.8 Auto-allumage
- 3.9 Viscosité
- 3.10 Acidité
- 3.11 Décomposition
- 3.12 Corrosivité
- 3.13 Polymérisation
- 4 utilisations
- 4.1 Sels de phosphate et utilisations générales
- 4.2 Industriel
- 4.3 Dentaire
- 4.4 Cosmétiques
- 5 Formation d'acide phosphorique
- 6 risques
- 7 Références
Structure chimique
L'acide phosphorique est constitué d'une liaison P = O et de trois P-OH, ces derniers étant les porteurs des hydrogènes acides libérés dans un milieu de dissolution. Avec l'atome de phosphore au centre, les oxygènes dessinent une sorte de tétraèdre moléculaire.
De cette manière, l'acide phosphorique peut être visualisé sous la forme d'un tétraèdre. De ce point de vue, les tétraèdres (par unités de H3PO4) interagissent les uns avec les autres par des liaisons hydrogène; c'est-à-dire que ses sommets se rapprochent étroitement.
Ces interactions intermoléculaires permettent à l'acide phosphorique de cristalliser en deux solides: l'anhydre et l'hémihydrate (H3PO41 / 2HdeuxO), tous deux avec des systèmes cristallins monocliniques. Sa forme anhydre peut également être décrite par la formule: 3HdeuxO · PdeuxOU ALORS5, qui est égal à un pentoxyde de phosphore trihydraté.
Les tétraèdres peuvent même devenir liés de manière covalente, mais pour cela, l'une de leurs unités doit éliminer une molécule d'eau par déshydratation. Cela se produit lorsque le H3PO4 est soumis à un chauffage, et génère par conséquent la formation d'acides polyphosphoriques (PA).
Acide diphosphorique (H4PdeuxOU ALORS7)
Le plus simple de tous les AP est l'acide diphosphorique (H4PdeuxOU ALORS7), également connu sous le nom d'acide pyrophosphorique. L'équation chimique de sa formation est la suivante:
2H3PO4 <=> H4PdeuxOU ALORS7 + HdeuxOU ALORS
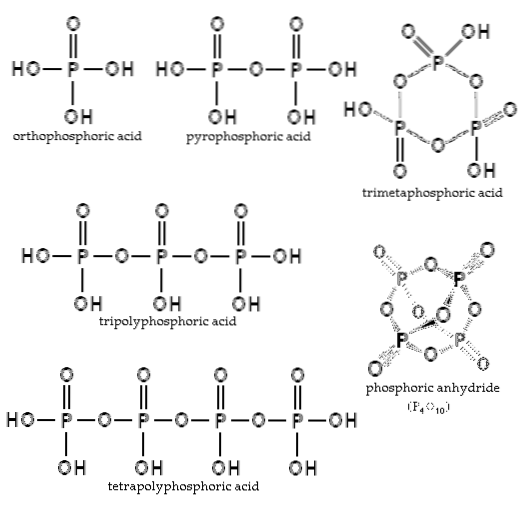
L'équilibre dépend de la quantité d'eau et de la température. Quelle est sa structure? Sur l'image de la coupe, les structures de l'acide orthophosphorique et de l'acide pyrophosphorique sont illustrées dans le coin supérieur gauche..
Deux unités sont jointes de manière covalente lorsqu'une molécule d'eau est éliminée, formant un pont oxygène P-O-P entre elles. Maintenant, ce ne sont pas trois hydrogènes acides, mais quatre (quatre groupes -OH). Pour cette raison, le H4PdeuxOU ALORS7 a quatre constantes d'ionisation kà.
Acides polyphosphoriques
La déshydratation peut avoir lieu avec de l'acide pyrophosphorique si le chauffage se poursuit. Parce que? Parce qu'à chaque extrémité de sa molécule se trouve un groupe OH qui peut être éliminé sous forme de molécule d'eau, favorisant ainsi la croissance ultérieure du squelette P-O-P-O-P ...
Des exemples de ces acides sont les acides tripolyphosphorique et tétrapolyphosphorique (tous deux illustrés sur l'image). On peut voir comment le squelette P-O-P s'allonge dans une sorte de chaîne composée de tétraèdres.
Ces composés peuvent être représentés par la formule HO (POdeuxOH)XH, où HO est l'extrême gauche qui peut être déshydratée. POdeuxOH est le squelette phosphore avec les liaisons P = O et OH; et x sont les unités ou molécules d'acides phosphoriques nécessaires pour obtenir ladite chaîne.
Lorsque ces composés sont complètement neutralisés avec une base, des polyphosphates sont créés. Selon les cations qui les entourent, ils forment une grande variété de sels polyphosphates.
D'autre part, s'ils réagissent avec des alcools ROH, les hydrogènes de leur squelette sont remplacés par les substituants R-alkyle. Ainsi, les esters phosphates (ou polyphosphates) surgissent: RO (POdeuxOU ALORS)XR. Il suffit de remplacer le H par R dans toutes les structures de l'image de la coupe pour les obtenir.
Acides polyphosphoriques cycliques
Les chaînes P-O-P peuvent même se fermer sur un anneau ou un cycle phosphorique. Le plus simple de ce type de composé est l'acide trimétaphosphorique (coin supérieur droit de l'image). Ainsi, les AP peuvent être linéaires, cycliques; ou si leurs structures présentent les deux types, ramifiées.
Nomenclature
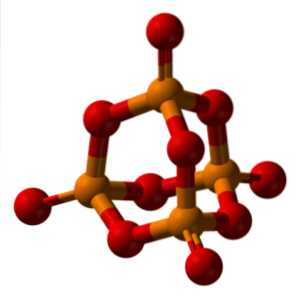
La nomenclature de l'acide phosphorique est dictée par l'IUPAC et comment les sels ternaires des oxoacides sont nommés.
Parce que dans le H3PO4 l'atome P a la valence +5, la valeur la plus élevée, son acide reçoit le suffixe -ico au préfixe phosphore-.
Ortho
Cependant, l'acide phosphorique est aussi communément appelé acide orthophosphorique. Parce que? Parce que le mot «ortho» est grec et signifie «vrai»; qui se traduirait par la "vraie forme" ou "plus hydratée" de la même.
Lorsque le phosphorique anhydre est hydraté avec un excès d'eau (P4OU ALORSdix, le «capuchon» du luminophore dans l'image ci-dessus) est produit H3PO4 (3HdeuxO · PdeuxOU ALORS5). Ainsi, le préfixe ortho est attribué aux acides formés avec de l'eau abondante.
Pyro
Le préfixe pyro désigne tout composé provenant de l'application de chaleur, puisque l'acide diphosphorique provient de la déshydratation thermique de l'acide phosphorique. Il est donc appelé acide pyrophosphorique (2HdeuxO · PdeuxOU ALORS5).
But
Le préfixe meta, qui est également un mot grec, signifie «après». Il est ajouté aux substances dont la formule a éliminé une molécule, dans ce cas, celle de l'eau:
H3PO4 => HPO3 + HdeuxOU ALORS
Notez que cette fois, l'addition de deux unités phosphoriques ne se produit pas pour former de l'acide diphosphorique, mais plutôt de l'acide métaphosphorique (dont il n'y a aucune preuve de son existence).
Il est également important de noter que cet acide peut être décrit comme HdeuxO · PdeuxOU ALORS5 (similaire à l'hémidrate, multipliant HPO3 Pour 2). Le préfixe méta correspond parfaitement au PA cyclique, car si l'acide triphosphorique se déshydrate, mais n'ajoute pas une autre unité H3PO4 pour devenir de l'acide tétraphosphorique, alors il doit former un anneau.
Et c'est la même chose avec d'autres acides polymétaphosphoriques, bien que l'IUPAC recommande de les appeler composés cycliques des PA correspondants..
Propriétés
Formule moléculaire
H3PO4
Poids moléculaire
97,994 g / mol
Aspect physique
Sous sa forme solide, il présente des cristaux orthorhombiques, hygroscopiques et transparents. Sous forme liquide, il est cristallin avec l'apparence d'un sirop visqueux..
Il est disponible dans le commerce en solution aqueuse avec une concentration de 85% p / p. Dans toutes ces présentations il manque d'odeur.
Points d'ébullition et de fusion
158 ° C (316 ° F à 760 mmHg).
108 ° F (42,2 ° C).
Solubilité dans l'eau
548 g / 100 g HdeuxOu à 20 ° C; 369,4 g / 100 ml à 0,5 ° C; 446 g / 100m à 14,95 ° C.
Densité
1 892 g / cm3 (solide); 1,841 g / cm3 (Solution à 100%); 1,685 g / cm3 (Solution à 85%); 1 334 g / cm3 Solution à 50%) à 25 ° C.
Densité de vapeur
Par rapport à l'air 3,4 (air = 1).
Allumage automatique
Ce n'est pas inflammable.
Viscosité
3,86 mPoise (solution à 40% à 20 ° C).
Acidité
pH: 1,5 (solution 0,1 N dans l'eau)
pKa: pKa1 = 2,148; pKa2 = 7,198 et pKa3 = 12,319. Par conséquent, votre hydrogène le plus acide est le premier.
Décomposition
Lorsqu'il est chauffé, il libère des oxydes de phosphore. Si la température monte à 213 ° C ou plus, il devient de l'acide pyrophosphorique (H4PdeuxOU ALORS7).
Corrosivité
Corrosif pour les métaux ferreux et l'aluminium. La réaction avec ces métaux donne naissance à l'hydrogène du gaz combustible.
Polymérisation
Polymérise violemment avec des composés azoïques, des époxydes et des composés polymérisables.
Applications
Sels de phosphate et utilisations générales
-L'acide phosphorique sert de base à la fabrication des phosphates, qui sont utilisés comme engrais car le phosphore est un nutriment principal dans les plantes..
-Il a été utilisé dans le traitement du saturnisme et d'autres conditions dans lesquelles des quantités importantes de phosphate sont nécessaires et la production d'une acidose légère.
-Il est utilisé pour contrôler le pH des voies urinaires du vison et les dépenses afin d'éviter la formation de calculs rénaux.
-L'acide phosphorique donne naissance à des sels de NadeuxHPO4 et NaHdeuxPO4 qui constituent un système tampon de pH avec un pKa de 6,8. Ce système de régulation du pH est présent chez l'homme, étant important dans la régulation du pH intracellulaire, ainsi que dans la gestion de la concentration d'hydrogène dans les tubules distaux et collecteurs des néphrons..
-Il est utilisé dans l'élimination de la couche moisie d'oxyde de fer qui s'accumule sur ce métal. L'acide phosphorique forme du phosphate de fer qui peut être facilement éliminé de la surface métallique. Il est également utilisé dans le polissage électrique de l'aluminium et est un liant pour les produits réfractaires tels que l'alumine et la magnésie..
Industriel
-L'acide phosphorique est utilisé comme agent catalytique dans la fabrication du nylon et de l'essence. Il est utilisé comme agent déshydratant dans la gravure lithographique, dans la production de colorants destinés à l'industrie textile, dans le processus de coagulation du latex dans l'industrie du caoutchouc et dans la purification du peroxyde d'hydrogène..
-L'acide est utilisé comme additif dans les boissons gazeuses, contribuant ainsi à sa saveur. Dilué est appliqué dans le processus de raffinage du sucre. Il agit également comme un système tampon dans la préparation du jambon, de la gélatine et des antibiotiques..
-Il intervient dans la production de détergents, dans la catalyse acide de la production d'acétylène.
-Il est utilisé comme acidulant dans les aliments équilibrés pour l'industrie de l'élevage et les animaux de compagnie. L'industrie pharmaceutique l'utilise dans la fabrication de médicaments antiémétiques. Il est également utilisé dans un mélange pour fabriquer de l'asphalte pour paver le sol et réparer les fissures..
-L'acide phosphorique agit comme un catalyseur dans la réaction d'hydratation des alcènes pour produire de l'alcool, principalement de l'éthanol. De plus, il est utilisé dans la détermination du carbone organique dans les sols.
Dentaire
Il est utilisé par les dentistes pour nettoyer et conditionner la surface de la dent avant la mise en place des appareils dentaires. Il trouve également une utilisation dans le blanchiment des dents et l'élimination des plaques dentaires. De plus, il est utilisé dans la fabrication d'adhésifs pour prothèses dentaires.
Produits de beauté
L'acide phosphorique est utilisé pour ajuster le pH dans les produits cosmétiques et de soins de la peau. Il est utilisé comme agent oxydant chimique pour la production de charbon actif..
Formation d'acide phosphorique
-L'acide phosphorique est préparé à partir de roches phosphatées de type apatite, par digestion avec de l'acide sulfurique concentré:
AC3(PO4)deux + 3 HdeuxSW4 + 6 heuresdeuxO => 2 H3PO4 + 3 (CaSO4.2HdeuxOU ALORS)
L'acide phosphorique obtenu dans cette réaction est de faible pureté, il subit donc un processus de purification qui comprend des techniques de précipitation, d'extraction par solvant, de cristallisation et d'échange d'ions..
-L'acide phosphorique peut être produit en dissolvant du pentoxyde de phosphore dans l'eau bouillante.
-Il peut également être obtenu en chauffant le phosphore avec un mélange d'air et de vapeur d'eau:
P4 (l) + 5 Odeux (g) => P4OU ALORSdix (s)
P4OU ALORSdix (s) + HdeuxO (g) => 4H3PO4 (l)
Des risques
-Comme sa pression de vapeur est faible à température ambiante, il est peu probable que ses vapeurs soient inhalées à moins que de l'acide ne soit pulvérisé. Si tel est le cas, vos symptômes d'inhalation comprennent: toux, mal de gorge, essoufflement et respiration difficile..
-La littérature cite le cas d'un marin qui a été exposé pendant une longue période à des vapeurs d'acide phosphorique. Il a souffert d'une faiblesse générale, d'une toux sèche, de douleurs thoraciques et de problèmes respiratoires. Moins d'un an après l'exposition, un dysfonctionnement réactif des voies respiratoires a été observé.
-Le contact cutané avec l'acide phosphorique peut provoquer des rougeurs, des douleurs, des cloques et des brûlures de la peau..
-Le contact de l'acide avec les yeux, en fonction de sa concentration et de la durée du contact, peut provoquer des lésions des tissus corrosifs ou des brûlures graves avec des lésions oculaires permanentes..
-L'ingestion de l'acide provoque des brûlures de la bouche et de la gorge, une sensation de brûlure au-delà du sternum, des douleurs abdominales, des vomissements, un choc et un collapsus.
Les références
- Société royale de chimie. (2015). Acide phosphorique. Tiré de: chemspider.com
- Centre canadien d'hygiène et de sécurité au travail. (1999). Acide phosphorique - Effets sur la santé. Tiré de: ccsso.ca
- Acides.Info. (2018). Acide phosphorique "Variété d'utilisations de ce composé chimique. Tiré de: acidos.info
- James P. Smith, Walter E. Brown et James R. Lehr. (1955). Structure de l'acide phosphorique cristallin. J. Am. Chem. Soc. 77, 10, 2728-2730
- Wikipédia. (2018). Acides phosphoriques et phosphates. Tiré de: en.wikipedia.org
- La science est amusante. En savoir plus sur l'acide phosphorique. [PDF]. Tiré de: scifun.chem.wisc.edu
Personne n'a encore commenté ce post.