
Structure de l'acide gallique, propriétés, obtention, utilisations

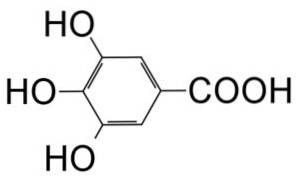
le Acide gallique est un composé organique de formule moléculaire C6Hdeux(OH)3COOH qui appartient à la catégorie des polyphénols. Il est reconnu comme une poudre cristalline de couleur blanche proche du jaune pâle..
Il s'agit d'un acide trihydroxybenzoïque formé par un cycle benzénique auquel sont fixés un groupe acide carboxylique (-COOH) et 3 groupes hydroxyle (-OH) situés en positions 3, 4 et 5 du cycle..
Dans la nature, il est largement diffusé, car il s'agit d'un produit qui se forme en quantités importantes dans les plantes et les champignons. Il existe libre ou attaché aux tanins de la plupart des espèces végétales, où se distinguent les noix, les raisins, les plantes divi-divi, l'écorce de chêne, la grenade ou ses racines, les sumacs et le thé..

On le trouve également dans le miel, le cacao, diverses baies, la mangue et d'autres fruits et légumes, et dans certaines boissons telles que le vin et les infusions de thé..
Dans les tissus végétaux, il se présente sous la forme d'un ester ou d'un gallate. La quantité dans laquelle il se trouve dépend de stimuli externes, tels que la quantité de rayonnement UV que la plante a reçu, le stress chimique et les infections microbiennes..
Dans le cas du raisin et du vin, cela dépend du cépage, de la transformation et du stockage. Dans le thé vert, la teneur en gallates est élevée, mais le cacao contient plus que le thé vert et le vin rouge.
Chimiquement, il se comporte comme un agent réducteur. Il est astringent et antioxydant. Il a également été utilisé dans les encres d'écriture bleues et est couramment utilisé dans l'industrie pharmaceutique..
Il a un large potentiel dans les applications médicales, car les multiples propriétés de l'acide gallique et de ses dérivés en font un agent thérapeutique prometteur en médecine préventive..
Index des articles
- 1 Structure
- 2 Nomenclature
- 3 propriétés
- 3.1 État physique
- 3.2 Poids moléculaire
- 3.3 Point de fusion
- 3.4 Densité
- 3.5 Solubilité
- 3.6 Constante de dissociation
- 3.7 Propriétés chimiques
- 3.8 Autres propriétés
- 4 Obtention
- 5 utilisations
- 5.1 - Dans les encres et colorants
- 5.2 - Dans les applications médicales
- 5.3 - Dans les applications médicales potentielles
- 5.4 - Dans les usages vétérinaires
- 5.5 - Dans diverses applications
- 5.6 - Utilité dans les milieux aquatiques naturels
- 6 Références
Structure
L'acide gallique cristallise dans le méthanol absolu ou dans le chloroforme sous forme d'aiguilles blanches. Cristallise dans l'eau sous forme d'aiguilles soyeuses à partir de son monohydrate.
Nomenclature
- Acide gallique.
- Acide 3,4,5-trihydroxybenzoïque.
Propriétés
État physique
Aiguilles solides et cristallines.
Poids moléculaire
170,12 g / mol.
Point de fusion
Il se décompose à 235-240 ºC, générant du pyrogallol et du COdeux
Densité
1,694 g / cm3
Solubilité
Dans l'eau: modérément soluble.
- 1 g dans 87 ml d'eau
- 1 g dans 3 ml d'eau bouillante
Dans l'éthanol: 1 g dans 6 ml d'alcool.
Dans l'éther diéthylique: 1 g dans 100 ml d'éther.
Dans le glycérol: 1 g dans 10 ml de glycérol.
Dans l'acétone: 1 g dans 5 ml d'acétone.
Pratiquement insoluble dans le benzène, le chloroforme et le pétrole léger.
Constante de dissociation
K1 4,63 x 10-3 (à 30 ºC).
Kdeux 1,41 x 10-9
Propriétés chimiques
Les solutions d'acide gallique, en particulier les sels de métaux alcalins, absorbent l'oxygène et virent au brun lorsqu'elles sont exposées à l'air.
L'acide gallique est un agent réducteur puissant qui peut réduire les sels d'or ou d'argent en métal. Il est incompatible avec les chlorates, le permanganate, l'ammoniac, l'acétate de plomb, les hydroxydes alcalins, les carbonates alcalins, les sels d'argent et les agents oxydants en général..
Avec les sels de fer (II), l'acide gallique forme un complexe bleu profond.
Dans l'acide gallique, le groupe hydroxyle (-OH) en position 4 est le plus réactif chimiquement.
Autres propriétés
Il doit être protégé de la lumière car il le dégrade photochimiquement.
C'est un léger irritant local. L'inhalation de poussière peut affecter le nez et la gorge et le contact avec les yeux et la peau provoque une irritation..
Les études de toxicité chez la souris indiquent qu'ingéré jusqu'à un niveau de 5000 mg / kg, l'acide gallique n'est pas toxique pour ces animaux. Il est considéré comme une faible toxicité et confirme la sécurité de son utilisation.
Obtention
L'acide gallique est obtenu par hydrolyse alcaline ou acide des tanins de fruits à coque ou de matières végétales riches en ces composés..
L'hydrolyse peut également être réalisée par voie enzymatique en utilisant des bouillons de culture de moisissures tels que Penicillium glaucum ou la Aspergillus niger, qui contiennent de la tannase, une enzyme qui brise ou clive la molécule de tanin.
Une autre manière d'obtenir de l'acide gallique est à partir de l'acide p-hydroxybenzoïque, par sulfonation et fusion alcaline, avec laquelle l'addition des deux autres groupes -OH dans la molécule est réalisée..
Applications
- Dans les encres et colorants
L'acide gallique est utilisé dans la fabrication d'anthragalol et de pyrogallol, qui sont des intermédiaires dans la production de colorants, tels que la gallocyanine et la galoflavine. À son tour, c'est une matière première dans la synthèse de dérivés d'oxazine, qui sont également utilisés comme colorants..
Puisqu'il forme un complexe bleu avec le fer, l'acide gallique est très important dans la production d'encres d'écriture. Ces encres contiennent principalement un mélange d'acide gallique, de sulfate ferreux (FeSO4) et gomme arabique.
Les encres à base d'acide gallique et de fer sont des matériaux indispensables pour rédiger des documents, dessiner des plans et préparer des documents écrits..

- Dans les applications médicales
Il est utilisé comme astringent intestinal et comme agent d'arrêt des saignements (styptique). L'acide gallique est la matière première pour l'obtention du rufigalol, qui est un antipaludéen..
En raison de sa capacité de réduction chimique, l'acide gallique est utilisé dans la fabrication de produits pharmaceutiques..
- Dans des applications médicales potentielles
Contre le cancer
L'acide gallique a été identifié comme le principal responsable des propriétés anticancéreuses de plusieurs extraits de plantes.
Contrairement à son action antioxydante particulière, il a été constaté qu'il pouvait présenter des caractéristiques pro-oxydantes dans l'induction de l'apoptose des cellules cancéreuses. L'apoptose est la destruction ordonnée des cellules endommagées causée par le même organisme.
Il est prouvé que l'acide gallique et les gallates induisent une apoptose sélective dans les cellules tumorales à croissance rapide, laissant les cellules saines intactes. En outre, il a été rapporté qu'il ralentit l'angiogenèse et, par conséquent, l'invasion du cancer et les métastases.
Une activité anticancéreuse de l'acide gallique a été trouvée dans la leucémie, le cancer de la prostate, du poumon, de l'estomac, du pancréas et du côlon, le cancer du sein, du col de l'utérus et de l'œsophage.
Contre diverses pathologies
Dans plusieurs études, il a été montré qu'il a une activité antifongique, antibactérienne, antivirale, antiallergique, anti-inflammatoire, antimutagène, anti-cholestérol, antiobésité et immunomodulatrice..
L'acide gallique est un bon candidat pour contrôler la maladie parodontale (maladie des gencives).
Il présente également un potentiel neuroprotecteur, cardioprotecteur, hépatoprotecteur et néphroprotecteur. Par exemple, plusieurs études sur les tissus cardiaques chez le rat ont confirmé que l'acide gallique exerce un effet protecteur sur le myocarde contre le stress oxydatif..
En tant qu'agent anti-âge cellulaire
L'acide gallique offre une protection efficace contre les dommages oxydatifs causés par des espèces réactives souvent présentes dans les systèmes biologiques, comme les radicaux hydroxyles (OH.), superoxyde (Odeux.) et peroxyle (ROO.).
Il s'est avéré être absorbé plus rapidement par le tube digestif que la plupart des polyphénols. Et c'est l'un de ceux qui ont la plus grande capacité antioxydante.
De plus, certains chercheurs affirment que l'acide gallique peut être transporté par les niosomes pour augmenter son activité anti-âge. Le niosome est un système moléculaire pour la libération contrôlée de médicaments à la place du corps qui en a besoin.
Ces caractéristiques lui confèrent un potentiel élevé contre le vieillissement cellulaire..
- Dans les usages vétérinaires
Il a été utilisé comme astringent intestinal chez les animaux.
- Dans diverses applications
L'acide gallique est utilisé dans la fabrication de ses esters, tels que le gallate de méthyle, le gallate de propyle, le gallate d'octyle et le gallate de lauryle..
Ces dérivés sont largement utilisés comme antioxydants et conservateurs dans les aliments transformés, dans les matériaux d'emballage alimentaire, pour éviter le rancissement et la détérioration oxydative. Les dérivés mentionnés sont également utilisés en cosmétique.
L'acide gallique est utilisé comme révélateur photographique et dans la fabrication du papier. De plus, il est largement utilisé dans la stabilisation du collagène dans le processus de tannage du cuir..
En tant que réactif analytique, l'acide gallique est idéal comme standard pour déterminer la teneur phénolique des extraits de plantes, et les résultats sont exprimés en équivalents d'acide gallique..
Il est également utilisé dans les tests de détermination des acides minéraux libres, de la dihydroxyacétone et des alcaloïdes..
- Utilité dans les milieux aquatiques naturels
L'acide gallique, naturellement présent dans les aquifères dans la matière végétale, est l'un de ceux responsables de la disponibilité nutritionnelle du Fe (II) nécessaire à la croissance des espèces aquatiques.
En effet, il est capable de maintenir des niveaux élevés de concentration en fer dissous (II) dans des conditions aérobies. En effet, il forme un complexe avec Fe (II) résistant à l'oxydation..

Les références
- Sajid, M. et coll. (2019). Livraison de phytomédicaments à base de nanoparticules: défis et opportunités. Dans New Look à la phytomédecine. Chapitre 23. Récupéré de sciencedirect.com.
- Windholz, M.; Budavari, S.; Blumetti, R. F. et Otterbein, E. (éditeurs) (1983). L'indice Merck. Dixième édition. Merck & CO., Inc.
- CRC Handbook of Chemistry and Physics. 75e 1994. CRC Press, Inc.
- Encyclopédie Ullmann de chimie industrielle. (1990). Cinquième édition. Volume A13. VCH Verlagsgesellschaft mbH.
- Badhani, B; Sharma, N. et Kakkar, R. (2015). Acide gallique: un antioxydant polyvalent aux applications thérapeutiques et industrielles prometteuses. RSC Advances. Récupéré de rsc.org.
- Zanwar, Anand A. et coll. (2014). Rôle de l'acide gallique dans les troubles cardiovasculaires. Dans les polyphénols dans la santé humaine et la maladie. Chapitre 80. Récupéré de sciencedirect.com.
- Nowak, R. et coll. (2014). Polyphénols végétaux comme agents chimiopréventifs. Dans les polyphénols dans la santé humaine et la maladie. Chapitre 97. Récupéré de sciencedirect.com.


Personne n'a encore commenté ce post.