
Structure, synthèse, propriétés et utilisations de l'acide picrique
le acide picrique est un composé chimique organique hautement nitré dont le nom IUPAC est 2,4,6-trinitrophénol. Sa formule moléculaire est C6Hdeux(NE PASdeux)3OH. C'est un phénol très acide, et peut être trouvé sous forme de picrate de sodium, d'ammonium ou de potassium; c'est-à-dire sous sa forme ionique C6Hdeux(NE PASdeux)3Sur un.
C'est un solide avec un fort goût amer, et de là il tire son nom du mot grec «prikos», qui signifie amer. Il se trouve sous forme de cristaux jaunes humides. Sa dessiccation ou sa déshydratation est dangereuse, car elle augmente les propriétés instables qui la rendent explosive.
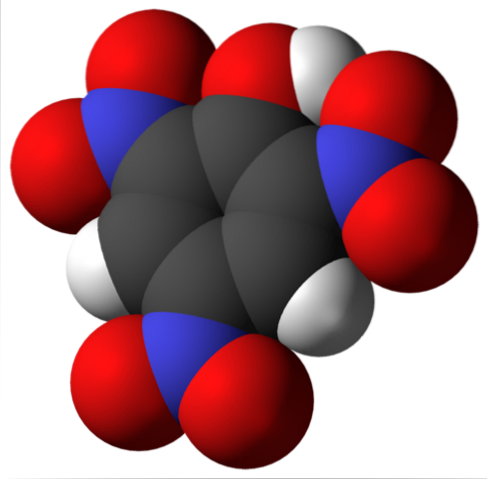
La molécule d'acide picrique est indiquée ci-dessus. Dans l'image, il est difficile de reconnaître les liaisons et les atomes car cela correspond à la représentation de sa surface de Van der Waals. La section suivante aborde la structure moléculaire plus en détail..
Certains composés intermédiaires, divers sels de picrate et complexes d'acide picrique sont synthétisés à partir d'acide picrique..
L'acide picrique est utilisé comme base pour la synthèse de colorants jaunes permanents. Certains pathologistes et chercheurs l'utilisent dans la fixation ou la coloration de coupes de tissus et d'autres processus immunohistochimiques..
Il est très utile dans la fabrication de produits pharmaceutiques. De plus, il est utilisé dans la production d'allumettes et d'explosifs. Il est également utilisé pour graver des métaux, pour fabriquer du verre coloré et dans la détermination colorimétrique de paramètres biologiques tels que la créatinine..
En revanche, l'acide picrique est irritant au contact de la peau, des muqueuses respiratoires, oculaires et digestives. En plus d'endommager la peau, il peut gravement affecter les reins, le sang et le foie, entre autres organes..
Index des articles
- 1 Structure
- 1.1 Phénol acide
- 1.2 Structure cristalline
- 2 Synthèse
- 2.1 Nitration directe du phénol
- 3 Propriétés physiques et chimiques
- 3.1 Poids moléculaire
- 3.2 Apparence physique
- 3.3 Odeur
- 3.4 Saveur
- 3.5 Point de fusion
- 3.6 Point d'ébullition
- 3.7 Densité
- 3.8 Solubilité
- 3.9 Corrosivité
- 3,10 pKa
- 3.11 Instabilité
- 4 utilisations
- 4.1 Recherche
- 4.2 Chimie organique
- 4.3 Dans l'industrie
- 4.4 Applications militaires
- 5 Toxicité
- 6 Références
Structure

L'image du haut montre plus en détail toutes les liaisons et la structure elle-même de la molécule d'acide picrique. Il se compose d'un phénol avec trois substituants nitro.
On peut voir que dans les groupes NONdeux l'atome d'azote a une charge partielle positive, et demande donc la densité électronique de son environnement. Mais, l'anneau aromatique attire également les électrons vers lui-même, et avant les trois NOdeux finit par abandonner une partie de sa propre densité électronique.
En conséquence, l'oxygène du groupe OH a davantage tendance à partager une de ses paires électroniques libres pour alimenter le déficit électronique subi par l'anneau; et ce faisant, la liaison C = O est formée+-H. Cette charge positive partielle sur l'oxygène affaiblit la liaison O-H et augmente l'acidité; c'est-à-dire qu'il sera libéré sous forme d'ion hydrogène, H+.
Acide phénol
C'est pour cette raison que ce composé est un acide exceptionnellement fort (et réactif), encore plus que l'acide acétique lui-même. Cependant, le composé est en fait un phénol dont l'acidité dépasse celle des autres phénols; en raison, comme je viens de le mentionner, des substituants NOdeux.
Par conséquent, puisqu'il s'agit d'un phénol, le groupe OH a la priorité et dirige le dénombrement dans la structure. Les trois NONdeux ils sont situés aux carbones 2, 4 et 6 du cycle aromatique par rapport à OH. C'est ici que la nomenclature IUPAC pour ce composé est dérivée: 2,4,6-Trinitrophénol (TNP).
Si les groupes n'étaient pas là, NONdeux, ou s'il y en avait un plus petit nombre dans le cycle, la liaison O-H s'affaiblirait moins, et donc le composé aurait moins d'acidité.
Structure en cristal
Les molécules d'acide picrique sont disposées de telle manière qu'elles favorisent leurs interactions intermoléculaires; soit pour la formation de liaisons hydrogène entre les groupes OH et NOdeux, forces dipôle-dipôle ou répulsions électrostatiques entre régions déficientes en électrons.
On peut s'attendre à ce que les groupes NEdeux ils se repoussaient et s'orienteraient en direction des anneaux aromatiques voisins. De plus, les anneaux ne pourraient pas s'aligner les uns sur les autres en raison de répulsions électrostatiques accrues..
Produit de toutes ces interactions, l'acide picrique parvient à former un réseau tridimensionnel qui définit un cristal; dont la maille unitaire correspond à un système cristallin de type orthorhombique.
La synthèse
Initialement, il était synthétisé à partir de composés naturels tels que les dérivés de corne animale, les résines naturelles, entre autres. À partir de 1841, le phénol a été utilisé comme précurseur de l'acide picrique, suivant diverses voies ou par diverses procédures chimiques.
Comme déjà mentionné, c'est l'un des phénols les plus acides. Pour le synthétiser, le phénol subit d'abord un processus de sulfonation, suivi d'un processus de nitration..
La sulfonation du phénol anhydre est effectuée en traitant le phénol avec de l'acide sulfurique fumant, produisant des substitutions aromatiques électrophiles de H par des groupes sulfonate, SO3H, en position -orto et -para par rapport au groupe OH.
Ce produit, l'acide 2,4-phénoldisulfonique, subit le processus de nitration, en le traitant avec de l'acide nitrique concentré. Ce faisant, les deux groupes SO3H sont remplacés par des groupes nitro, NONdeux, et un troisième entre dans l'autre position nitro. L'équation chimique suivante illustre cela:
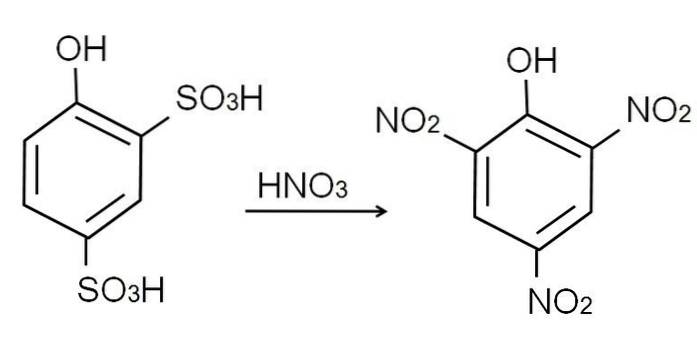
Nitration directe du phénol
Le processus de nitration au phénol ne peut pas être effectué directement, car des goudrons de poids moléculaire élevé sont générés. Cette méthode de synthèse nécessite un contrôle très minutieux de la température car elle est très exothermique:
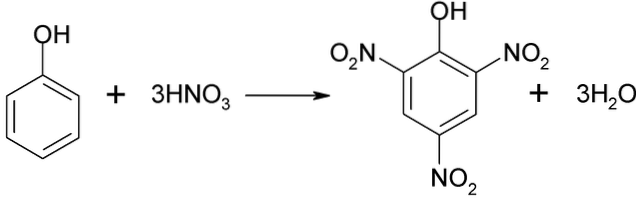
L'acide picrique peut être obtenu en effectuant le processus de nitration directe du 2,4-dinitrophénol, avec de l'acide nitrique.
Un autre moyen de synthèse consiste à traiter le benzène avec de l'acide nitrique et du nitrate mercurique..
Proprietes physiques et chimiques
Poids moléculaire
229,104 g / mol.
Apparence physique
Masse jaune ou suspension de cristaux humides.
Odeur
C'est inodore.
Goût
C'est très amer.
Point de fusion
122,5 ° C.
Point d'ébullition
300 ° C Mais, une fois fondu, il explose.
Densité
1,77 g / mL.
Solubilité
C'est un composé modérément soluble dans l'eau. C'est parce que ses groupes OH et NOdeux ils peuvent interagir avec les molécules d'eau par des liaisons hydrogène; bien que le cycle aromatique soit hydrophobe, et par conséquent altère sa solubilité.
Corrosivité
L'acide picrique est généralement corrosif pour les métaux, à l'exception de l'étain et de l'aluminium.
pKa
0,38. C'est un acide organique fort.
Instabilité
L'acide picrique est caractérisé par des propriétés instables. Il constitue un risque pour l'environnement, il est instable, explosif et toxique.
Il doit être conservé hermétiquement fermé pour éviter la déshydratation, car l'acide picrique est très explosif si on le laisse sécher. Il faut faire très attention à sa forme anhydre, car elle est très sensible aux frottements, aux chocs et à la chaleur..
L'acide picrique doit être stocké dans des endroits frais et ventilés, loin des matières oxydables. Il est irritant au contact de la peau et des muqueuses, ne doit pas être ingéré et est toxique pour le corps.
Applications
L'acide picrique a été largement utilisé dans la recherche, la chimie, l'industrie et l'armée..
Enquête
Lorsqu'il est utilisé comme fixateur pour les cellules et les tissus, il améliore les résultats de la coloration de ceux-ci avec des colorants acides. Cela se produit avec les méthodes de coloration au trichrome. Après avoir fixé le tissu avec du formol, une nouvelle fixation avec de l'acide picrique est recommandée..
De cette manière, une coloration intense et très lumineuse des tissus est garantie. Vous n'obtenez pas de bons résultats avec les colorants basiques. Cependant, des précautions doivent être prises, car l'acide picrique peut hydrolyser l'ADN s'il est laissé trop longtemps..
Chimie organique
-En chimie organique, il est utilisé comme picrates alcalins pour effectuer l'identification et l'analyse de diverses substances.
-Il est utilisé en chimie analytique des métaux.
-Dans les laboratoires cliniques, il est utilisé dans la détermination des taux de créatinine sérique et urinaire..
-Il a également été utilisé dans certains des réactifs utilisés pour l'analyse des taux de glucose..
Dans l'industrie
-Au niveau de l'industrie photographique, l'acide picrique a été utilisé comme sensibilisant dans les émulsions photographiques. Il a fait partie de la production de produits tels que des pesticides, des insecticides puissants, entre autres.
-L'acide picrique est utilisé pour synthétiser d'autres intermédiaires chimiques tels que la chloropicrine et l'acide picramique, par exemple. Certains médicaments et colorants pour l'industrie du cuir ont été fabriqués à partir de ces composés..
-L'acide picrique a été utilisé dans le traitement des brûlures, comme antiseptique et d'autres conditions, avant que sa toxicité ne devienne évidente..
-Composant important en raison de sa nature explosive dans la fabrication d'allumettes et de piles.
Applications militaires
-En raison de la forte explosivité de l'acide picrique, il a été utilisé dans les usines de munitions pour les armes militaires.
-L'acide picrique pressé et fondu a été utilisé dans les obus d'artillerie, les grenades, les bombes et les mines.
-Le sel d'ammonium d'acide picrique a été utilisé comme explosif, il est très puissant mais moins stable que le TNT. Pendant un certain temps, il a été utilisé comme composant de carburant de fusée.
Toxicité
Il a été prouvé qu'il est très toxique pour le corps humain et en général pour tous les êtres vivants.
Il est recommandé d'éviter l'inhalation et l'ingestion, en raison de sa toxicité orale aiguë. Il provoque également des mutations dans les micro-organismes. Il a des effets toxiques sur la faune, les mammifères et l'environnement en général.
Les références
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (dixe édition.). Wiley plus.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Wikipédia. (2018). Acide picrique. Récupéré de: en.wikipedia.org
- Université Purdue. (2004). Explosion d'acide picrique. Récupéré de: chemed.chem.purdue.edu
- Projet Crystallography 365. (10 février 2014). Moins de jaune doux - la structure de l'acide picrique. Récupéré de: crystallography365.wordpress.com
- PubChem. (2019). Acide picrique. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Acide picrique. Methuen, Londres, Royaume-Uni.

Personne n'a encore commenté ce post.