
Formule d'acide propanoïque, propriétés, risques et utilisations

le acide propanoïque est un acide gras saturé à chaîne courte comprenant de l'éthane lié au carbone d'un groupe carboxy. Sa formule est CH3-CHdeux-COOH.L'anion CH3CH2COO- ainsi que les sels et les esters de l'acide propanoïque sont connus sous le nom de propionates (ou propanoates).
Il peut être obtenu à partir de résidus de pâte de bois par procédé de fermentation à l'aide de bactéries du genre propionibactérie. Il est également obtenu à partir d'éthanol et de monoxyde de carbone à l'aide d'un catalyseur au trifluorure de bore (O'Neil, 2001).
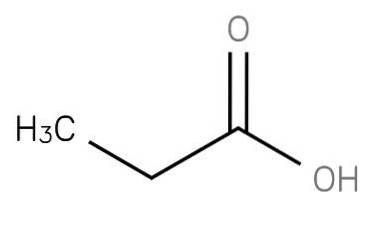
Une autre manière d'obtenir de l'acide propanoïque est l'oxydation du propionaldéhyde en présence d'ions cobalt ou manganèse. Cette réaction se déroule rapidement à des températures aussi basses que 40-50 ° C:
2CH3CHdeuxCHO + Odeux → 2CH3CHdeuxCOOH
Le composé est naturellement présent à de faibles niveaux dans les produits laitiers et est généralement produit, avec d'autres acides gras à chaîne courte, dans le tractus gastro-intestinal des humains et d'autres mammifères comme produit final de la digestion microbienne des glucides..
A une activité physiologique significative chez les animaux (Human Metabolome Database, 2017).
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 3 Biochimie
- 4 utilisations
- 5 Références
Proprietes physiques et chimiques
L'acide propanoïque est un liquide huileux incolore avec une odeur piquante, désagréable et rance. Son aspect est illustré à la figure 2 (National Center for Biotechnology Information, 2017).

L'acide propanoïque a un poids moléculaire de 74,08 g / mol et une densité de 0,992 g / ml. Ses points de congélation et d'ébullition sont respectivement de -20,5 ° C et 141,1 ° C. L'acide propanoïque est un acide faible dont le pKa est de 4,88.
Le composé est très soluble dans l'eau, pouvant dissoudre 34,97 grammes de composé pour 100 ml de solvant. Il est également soluble dans l'éthanol, l'éther et le chloroforme (Royal Society of Chemistry, 2015).
L'acide propanoïque a des propriétés physiques intermédiaires entre celles des acides carboxyliques plus petits, des acides formique et acétique et des acides gras plus gros..
Il montre les propriétés générales des acides carboxyliques et peut former des dérivés amide, ester, anhydride et chlorure. Il peut subir une alpha-halogénation avec du brome en présence de PBr3 comme catalyseur (la réaction HVZ) pour former CH3CHBrCOOH.
Réactivité et dangers
L'acide propanoïque est un matériau inflammable et combustible. Il peut être enflammé par la chaleur, des étincelles ou des flammes. Les vapeurs peuvent former des mélanges explosifs avec l'air, pouvant se déplacer jusqu'à la source d'inflammation et exploser.
La plupart des vapeurs sont plus lourdes que l'air. Ils seront répartis sur le sol et collectés dans des zones basses ou confinées (égouts, sous-sols, réservoirs). Risque d'explosion de vapeur à l'intérieur, à l'extérieur ou dans les égouts.
Les substances désignées par un (P) peuvent polymériser de manière explosive lorsqu'elles sont chauffées ou englouties dans un feu. Les conteneurs peuvent exploser lorsqu'ils sont chauffés (ACIDE PROPIONIQUE, 2016).
Le composé doit être tenu à l'écart de la chaleur ou des sources d'ignition. Lorsqu'il est chauffé jusqu'à décomposition, il émet une fumée âcre et des vapeurs irritantes.
L'acide propanoïque est irritant pour la peau, les yeux, le nez et la gorge mais ne produit pas d'effets systémiques aigus et n'a pas de potentiel génotoxique démontrable. En cas de contact, laver abondamment à l'eau (Fiche de données de sécurité Acide propionique, 2013).
Biochimie
La base conjuguée de l'acide propanoïque, le propionate, est formée sous forme de fragment terminal à trois carbones (activé avec la coenzyme A sous forme de propionyl-CoA) lors de l'oxydation d'acides gras de carbone impairs et de l'oxydation de la chaîne latérale du cholestérol.
Des expériences avec des isotopes radioactifs du propionate injectés à des rats à jeun indiquent qu'il peut apparaître dans le glycogène, le glucose, les intermédiaires du cycle de l'acide citrique, les acides aminés et les protéines..
La voie du métabolisme de l'acide propanoïque implique une interaction avec la coenzyme A, la carboxylation pour former le méthylmalonyl-coenzyme A et la conversion en acide succinique, qui entre dans le cycle de l'acide citrique.
L'acide propanoïque peut être oxydé sans former de corps cétoniques et, contrairement à l'acide acétique, il est incorporé à un glucide ainsi qu'à un lipide (Bingham, Cohrssen et Powell, 2001).
L'acidurie propionique est l'une des aciduries organiques les plus courantes, une maladie qui englobe de nombreux troubles divers.
Le résultat des patients nés avec une acidurie propionique est médiocre en termes de développement intellectuel, 60% ayant un QI inférieur à 75 et nécessitant une éducation spéciale.
La réussite des greffes hépatiques et / ou rénales chez quelques patients a permis d'améliorer la qualité de vie mais n'a pas nécessairement empêché les viscères et les complications neurologiques.
Ces résultats soulignent la nécessité d'une surveillance métabolique permanente, quelle que soit la stratégie thérapeutique..
Applications
L'acide propanoïque inhibe la croissance des bactéries et des moisissures à des niveaux compris entre 0,1 et 1% en poids. En conséquence, la majeure partie de l'acide propanoïque produit est consommée comme agent de conservation à la fois pour les aliments pour animaux et les denrées alimentaires destinées à la consommation humaine telles que les céréales et les céréales..
La conservation des aliments pour animaux, des céréales et des denrées alimentaires en plus de la production de propionates de calcium et de sodium, qui représente près de 80% de la consommation mondiale d'acide propanoïque en 2016, contre 78,5% en 2012.
Environ 51% de la consommation mondiale d'acide propanoïque est destinée à l'alimentation animale et à la conservation des céréales, tandis que près de 29% est utilisé dans la production de propionates de calcium et de sodium, qui sont également utilisés dans l'industrie alimentaire humaine et animale..
D'autres marchés importants pour l'acide propanoïque sont la production d'herbicides et de diéthylcétone. Les applications à faible volume comprennent la fabrication de propionate d'acétate de cellulose, de produits pharmaceutiques, d'esters de solvants, d'arômes et de parfums, de plastifiants, de colorants et d'auxiliaires pour le textile, le cuir et le caoutchouc.
La demande d'acide propanoïque dépend fortement de la production d'aliments pour animaux et de céréales, suivie des aliments emballés et des produits de boulangerie.
Les perspectives de croissance mondiale de l'acide propanoïque et de ses sels dans l'alimentation animale / les céréales et la conservation des aliments sont importantes (IHS Markit, 2016).
D'autres marchés à croissance rapide comprennent les esters de propionate pour solvants, tels que le n-butyle et le propionate de pentyle; Ces esters sont de plus en plus utilisés comme substituts aux solvants répertoriés comme polluants atmosphériques dangereux..
Les références
- Bingham, E., Cohrssen, B. et Powell, C. (2001). Patty's Toxicology Volumes 1-9 5e éd. New York: John Wiley & Sons.
- EMBL-EBI. (2016, 14 octobre). l'acide propionique. Récupéré de ChEBI: ebi.ac.uk.
- Base de données du métabolome humain. (2017, 2 mars). L'acide propionique. Récupéré de hmdb.ca: hmdb.ca.
- IHS Markit. (2016, décembre). Acide propionique. Récupéré de ihs: ihs.com.
- Fiche signalétique Acide propionique. (2013, 21 mai). Récupéré de sciencelab: sciencelab.com.
- Centre national d'information sur la biotechnologie… (22 avril 2017). Base de données des composés PubChem; CID = 1032. Récupéré de pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001). The Merck Index - An Encyclopedia of Chemicals, Drugs, and Biologicals. 13e édition. New Jersey: Merck and Co., Inc.
- L'ACIDE PROPIONIQUE. (2016). Récupéré de caméochimiques: cameochemicals.noaa.gov.
- Société royale de chimie. (2015). L'acide propionique. Récupéré de chemspider: chemspider.com.


Personne n'a encore commenté ce post.