
Structure, propriétés et utilisations du séléniure d'hydrogène (H2Se)

le hydrogène sélénium ou le séléniure d'hydrogène est un composé inorganique dont la formule chimique est HdeuxJe connais. Il est de nature covalente et, dans les conditions ordinaires de température et de pression, c'est un gaz incolore; mais avec une forte odeur reconnaissable à sa moindre présence. Chimiquement, c'est un chalcogénure, donc le sélénium a une valence de -2 (Sedeux-).
De tous les séléniures, le HdeuxC'est le plus toxique car sa molécule est petite et son atome de sélénium a moins d'encombrement stérique lors de la réaction. En revanche, son odeur permet à ceux qui travaillent avec elle de la détecter sur place en cas de fuite à l'extérieur de la hotte du laboratoire..
Le séléniure d'hydrogène peut être synthétisé par la combinaison directe de ses deux éléments: l'hydrogène moléculaire, Hdeux, et le sélénium métallique. Il peut également être obtenu par dissolution de composés riches en sélénium, tels que le séléniure de fer (II), FeSe, dans l'acide chlorhydrique..
D'autre part, le séléniure d'hydrogène est préparé en dissolvant du séléniure d'hydrogène dans l'eau; c'est-à-dire que le premier est dissous dans l'eau, tandis que le second est constitué de molécules gazeuses.
Son utilisation principale est d'être une source de sélénium en synthèse organique et inorganique.
Index des articles
- 1 Structure du séléniure d'hydrogène
- 2 propriétés
- 2.1 Apparence physique
- 2.2 Masse moléculaire
- 2.3 Point d'ébullition
- 2.4 Point de fusion
- 2.5 Pression de vapeur
- 2.6 Densité
- 2,7 pKa
- 2.8 Solubilité dans l'eau
- 2.9 Solubilité dans d'autres solvants
- 3 Nomenclature
- 3.1 Séléniure ou hydrure?
- 4 utilisations
- 4.1 Métabolique
- 4.2 Industriel
- 5 Références
Structure du séléniure d'hydrogène
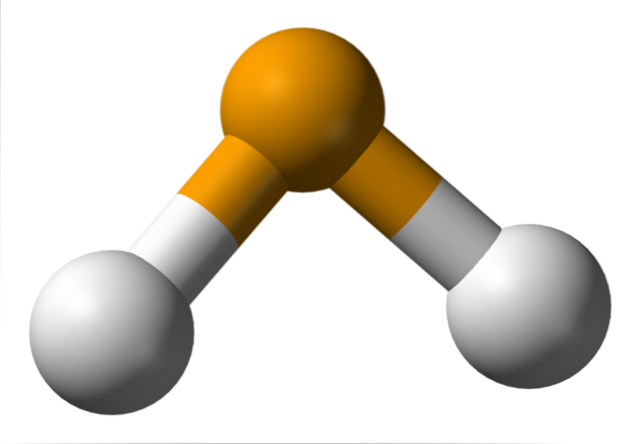
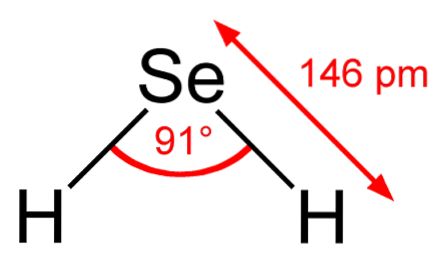
Dans l'image supérieure, on observe que la molécule de HdeuxIl est de géométrie angulaire, bien que son angle de 91 ° le fasse ressembler plus à un L qu'à un V. Dans ce modèle de sphères et de bâtonnets, les atomes d'hydrogène et de sélénium sont respectivement les sphères blanche et jaune..
Cette molécule, comme indiqué, est celle en phase gazeuse; c'est-à-dire pour le séléniure d'hydrogène. Lorsqu'il est dissous dans l'eau, il libère un proton et en solution nous avons la paire HSe- H3OU ALORS+; cette paire d'ions se transforme en séléniure d'hydrogène, notée HdeuxSe (ac) pour le différencier du séléniure d'hydrogène, HdeuxSe (g).
Par conséquent, les structures entre le HdeuxSe (ac) et HdeuxSe (g) sont très différents; le premier est entouré d'une sphère aqueuse et présente des charges ioniques, et le second est constitué d'un agglomérat de molécules en phase gazeuse.
Molécules de HdeuxIls peuvent à peine interagir les uns avec les autres par de très faibles forces dipôle-dipôle. Le sélénium, bien qu'il soit moins électronégatif que le soufre, concentre une densité d'électrons plus élevée en «l'éloignant» des atomes d'hydrogène..
Comprimés d'hydrures de sélénium
Si les molécules de HdeuxIls sont soumis à une pression extraordinaire (des centaines de GPa), ils sont théoriquement obligés de se solidifier par la formation de liaisons Se-H-Se; Ce sont des liaisons de trois centres et de deux électrons (3c-2e) où l'hydrogène participe. Par conséquent, les molécules commencent à former des structures polymères qui définissent un solide..
Dans ces conditions, le solide peut être enrichi en plus d'hydrogène, ce qui modifie complètement les structures résultantes. De plus, la composition devient de type HnSe, où n varie de 3 à 6. Ainsi, les hydrures de sélénium comprimés par ces pressions, et en présence d'hydrogène, ont les formules chimiques H3Se à H6je connais.
On estime que ces hydrures de sélénium enrichis en hydrogène ont des propriétés supraconductrices.
Propriétés
Apparence physique
Gaz incolore qui, à basse température, sent le radis pourri et les œufs pourris si sa concentration augmente. Son odeur est pire et plus intense que celle du sulfure d'hydrogène (ce qui est déjà assez désagréable). Cependant, c'est une bonne chose, car cela facilite sa détection et réduit les risques de contact prolongé ou d'inhalation..
Lorsqu'il brûle, il dégage une flamme bleuâtre des interactions électroniques dans les atomes de sélénium.
Masse moléculaire
80,98 g / mol.
Point d'ébullition
-41 ° C.
Point de fusion
-66 ° C.
La pression de vapeur
9,5 atm à 21 ° C.
Densité
3 553 g / L.
paquetà
3,89.
Solubilité dans l'eau
0,70 g / 100 ml. Cela corrobore le fait que l'atome de sélénium de HdeuxImpossible de former des liaisons hydrogène appréciables avec les molécules d'eau.
Solubilité dans d'autres solvants
-Soluble dans CSdeux, ce qui n'est pas surprenant en raison de l'analogie chimique entre le sélénium et le soufre.
-Soluble dans le phosgène (à basse température, car il bout à 8 ° C).
Nomenclature
Comme déjà expliqué dans les sections précédentes, le nom de ce composé varie selon que HdeuxIl est en phase gazeuse ou dissous dans l'eau. Lorsqu'il est dans l'eau, il est appelé séléniure d'hydrogène, qui n'est rien de plus qu'un hydracide en termes inorganiques. Contrairement aux molécules gazeuses, son caractère acide est plus important.
Cependant, qu'il soit gazeux ou dissous dans l'eau, l'atome de sélénium conserve les mêmes caractéristiques électroniques; par exemple, sa valence est de -2, sauf s'il subit une réaction d'oxydation. Cette valence de -2 est la raison pour laquelle on l'appelle seleniaurochs l'hydrogène, puisque l'anion séléniure est Sedeux-; qui est plus réactif et réducteur que Sdeux-, sulfure.
Si une nomenclature systématique est utilisée, le nombre d'atomes d'hydrogène dans le composé doit être spécifié. Ainsi, le HdeuxIl s'appelle: séléniure de donnéhydrogène.
Séléniure ou hydrure?
Certaines sources l'appellent un hydrure. Si c'était vraiment le cas, le sélénium aurait une charge positive de +2, et l'hydrogène aurait une charge négative de -1: SeHdeux (Je connaisdeux+, H-). Le sélénium est un atome plus électronégatif que l'hydrogène, et finit donc par «accumuler» la densité électronique la plus élevée dans la molécule Hdeuxje connais.
Cependant, en tant que tel, l'existence d'hydrure de sélénium ne peut être théoriquement exclue. En fait, avec la présence des anions H- Cela faciliterait les liaisons Se-H-Se, responsables des structures solides formées à d'énormes pressions selon des études informatiques.
Applications
Métabolique
Bien que cela semble contradictoire, malgré la grande toxicité de HdeuxIl est produit dans le corps par la voie métabolique du sélénium. Cependant, dès qu'il est produit, les cellules l'utilisent comme intermédiaire dans la synthèse des sélénoprotéines, ou il finit par être méthylé et excrété; l'un des symptômes en est le goût de l'ail dans la bouche.
Industriel
Le HdeuxIl est principalement utilisé pour ajouter des atomes de sélénium à des structures solides, telles que des matériaux semi-conducteurs; aux molécules organiques, telles que les alcènes et les nitriles pour la synthèse de séléniures organiques; ou à une solution pour précipiter les séléniures métalliques.
Les références
- Wikipédia. (2018). Séléniure d'hydrogène. Récupéré de: en.wikipedia.org
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Atomistry. (2012). Séléniure d'hydrogène, HdeuxJe connais. Récupéré de: selenium.atomistry.com
- Tang Y. et col. (2017). Séléniure d'hydrogène (HdeuxSe) Gaz dopant pour l'implantation de sélénium. 21e Conférence internationale sur la technologie d'implantation ionique (IIT). Tainan, Taiwan.
- Formulation chimique. (2018). Séléniure d'hydrogène. Récupéré de: formulacionquimica.com
- PubChem. (2019). Séléniure d'hydrogène. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Zhang, S. et al. (2015). Diagramme de phase et supraconductivité à haute température des hydrures de sélénium comprimés. Sci. Rep. 5, 15433; doi: 10.1038 / srep15433.
- Acides.Info. (2019). Acide sélénhydrique: propriétés et applications de cet hydracide. Récupéré de: acidos.info/selenhidrico



Personne n'a encore commenté ce post.