
Structure, propriétés et utilisations de l'acide iodhydrique (HI)

le acide iodhydrique C'est une solution aqueuse d'iodure d'hydrogène qui se caractérise par sa forte acidité. Une définition plus proche de la terminologie chimique et IUPAC est qu'il s'agit d'un hydracide, dont la formule chimique est HI.
Cependant, pour le différencier des molécules d'iodure d'hydrogène gazeux, HI (g) est noté HI (aq). C'est pour cette raison que dans les équations chimiques, il est important d'identifier le milieu ou la phase physique dans lequel se trouvent les réactifs et les produits. Même ainsi, la confusion entre l'iodure d'hydrogène et l'acide iodhydrique est courante..
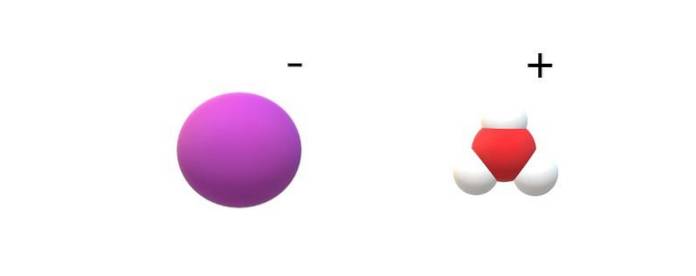
Si les molécules engagées dans leur identité sont observées, des différences notables seront trouvées entre HI (g) et HI (ac). Dans HI (g), il y a une liaison H-I; tandis qu'en HI (ac), ils sont en fait une paire d'ions I- et H3OU ALORS+ interagir électrostatiquement (image du haut).
D'autre part, HI (ac) est une source de HI (g), puisque le premier est préparé en dissolvant le second dans l'eau. Pour cette raison, à moins qu'il ne soit dans une équation chimique, HI peut également être utilisé pour désigner l'acide iodhydrique. HI est un agent réducteur puissant et une excellente source d'ions I.- en milieu aqueux.
Index des articles
- 1 Structure de l'acide iodhydrique
- 2 propriétés
- 2.1 Description physique
- 2.2 Masse moléculaire
- 2.3 Odeur
- 2.4 Densité
- 2.5 Point d'ébullition
- 2,6 pKa
- 2.7 Acidité
- 2.8 Agent réducteur
- 3 Nomenclature
- 4 utilisations
- 4.1 Source d'iode dans les synthèses organiques et inorganiques
- 4.2 Agent réducteur
- 4.3 Processus Cativa
- 4.4 Synthèses illicites
- 5 Références
Structure de l'acide iodhydrique
L'acide iodhydrique, comme il vient d'être expliqué, consiste en une solution de HI dans l'eau. Étant dans l'eau, les molécules HI se dissocient complètement (électrolyte fort), à l'origine des ions I- et H3OU ALORS+. Cette dissociation peut être représentée par l'équation chimique suivante:
HI (g) + HdeuxO (l) => I-(ac) + H3OU ALORS+(ac)
Qu'est-ce qui serait équivalent s'il était écrit comme suit:
HI (g) + HdeuxO (l) => HI (ac)
Cependant, HI (ac) ne révèle pas du tout ce qui est arrivé aux molécules de HI gazeuses; il indique seulement qu'ils sont en milieu aqueux.
Par conséquent, la vraie structure de HI (ac) est constituée des ions I- et H3OU ALORS+ entouré de molécules d'eau les hydratant; plus l'acide iodhydrique est concentré, plus le nombre de molécules d'eau non protonées est faible.
Commercialement, en fait, la concentration HI est de 48 à 57% dans l'eau; plus concentré équivaudrait à avoir trop d'acide fumant (et encore plus dangereux).
Dans l'image, on peut voir que l'anion I- est représenté par une sphère violette, et H3OU ALORS+ avec des sphères blanches et une rouge, pour l'atome d'oxygène. Le cation H3OU ALORS+ présente la géométrie moléculaire de la pyramide trigonale (vue d'un plan plus élevé dans l'image).
Propriétés
Description physique
Liquide incolore; mais, il peut présenter des tons jaunâtres et bruns s'il est en contact direct avec l'oxygène. C'est parce que les ions I- finissent par s'oxyder en iode moléculaire, jedeux. S'il y a beaucoup jedeux, il est plus que probable que l'anion triiodure se forme, je3-, qui tache la solution en brun.
Masse moléculaire
127,91 g / mol.
Odeur
Acre.
Densité
La densité est de 1,70 g / mL pour la solution à 57% HI; depuis, les densités varient en fonction des différentes concentrations de HI. A cette concentration, un azéotrope se forme (il est distillé en une seule substance et non en un mélange) à la stabilité relative duquel il peut être dû à sa commercialisation par rapport à d'autres solutions..
Point d'ébullition
L'azéotrope 57% HI bout à 127 ° C à une pression de 1,03 bar (GO TO ATM).
pKa
-1,78.
Acidité
C'est un acide extrêmement fort, à tel point qu'il est corrosif pour tous les métaux et tissus; même pour les caoutchoucs.
En effet, la liaison H-I est très faible et se rompt facilement lors de l'ionisation dans l'eau. De plus, les liaisons hydrogène I- - HOHdeux+ sont faibles, il n'y a donc rien qui puisse interférer avec le H3OU ALORS+ réagir avec d'autres composés; c'est-à-dire que le H3OU ALORS+ a été "libre", comme le je- qui n'attire pas avec trop de force son contre-ion.
Agent réducteur
HI est un agent réducteur puissant, dont le principal produit de réaction est Ideux.
Nomenclature
La nomenclature de l'acide iodhydrique dérive du fait que l'iode "fonctionne" avec un seul état d'oxydation: -1. Et aussi, le même nom indique qu'il a de l'eau dans sa formule structurelle [I-] [H3OU ALORS+]. C'est son seul nom, car ce n'est pas un composé pur mais une solution.
Applications
Source d'iode dans les synthèses organiques et inorganiques
HI est une excellente source d'ions I- pour les synthèses inorganiques et organiques, et est également un puissant réducteur. Par exemple, sa solution aqueuse à 57% est utilisée pour la synthèse d'iodures d'alkyle (comme CH3CHdeuxI) à partir d'alcools primaires. De même, un groupe OH peut être substitué à un I dans une structure.
Agent réducteur
L'acide iodhydrique a été utilisé pour réduire, par exemple, les glucides. Si le glucose dissous dans cet acide est chauffé, il perdra tous ses groupes OH, obtenant l'hydrocarbure n-hexane comme produit..
De même, il a été utilisé pour réduire les groupes fonctionnels des feuilles de graphène, de manière à ce qu'elles puissent être fonctionnalisées pour des dispositifs électroniques..
Processus Cativa

Pas
Le processus commence (1) avec le complexe organo-iridium [Ir (CO)deuxjedeux]-, géométrie plane carrée. Ce composé "reçoit" de l'iodure de méthyle, CH3I, produit de l'acidification du CH3OH avec 57% HI. De l'eau est également produite dans cette réaction, et grâce à elle, on obtient finalement de l'acide acétique, tout en permettant de récupérer le HI dans la dernière étape..
Dans cette étape, le groupe -CH3 comme -I ils se lient au centre métallique iridium (2), formant un complexe octaédrique avec une facette composée de trois ligands I. L'une des iodes finit par être remplacée par une molécule de monoxyde de carbone, CO; et maintenant (3), le complexe octaédrique a une facette composée de trois ligands CO.
Puis un réarrangement se produit: le groupe -CH3 il "se détache" de Ir et se lie au CO (4) adjacent pour former un groupe acétyle, -COCH3. Ce groupe est libéré du complexe d'iridium pour se lier aux ions iodure et donner CH3COI, iodure d'acétyle. Ici, le catalyseur à l'iridium est récupéré, prêt à participer à un autre cycle catalytique.
Enfin, le CH3IOC subit un remplacement du I- pour une molécule de HdeuxO, dont le mécanisme finit par libérer du HI et de l'acide acétique.
Synthèses illicites

On peut voir qu'une substitution du groupe OH pour I se produit en premier, suivie d'une seconde substitution pour un H.
Les références
- Wikipédia. (2019). Acide iodhydrique. Récupéré de: en.wikipedia.org
- Andrews, Natalie. (24 avril 2017). Les utilisations de l'acide hydriodique. Découvrir. Récupéré de: scaimer.com
- Alfa Aesar, Thermo Fisher Scientific. (2019). Acide hydriodique. Récupéré de: alfa.com
- Centre national d'information sur la biotechnologie. (2019). Acide hydriodique. Base de données PubChem., CID = 24841. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Steven A. Hardinger. (2017). Glossaire illustré de chimie organique: acide iodhydrique. Récupéré de: chem.ucla.edu
- Reusch William. (5 mai 2013). Les glucides. Récupéré de: 2.chemistry.msu.edu
- À Kyu Moon, Junghyun Lee, Rodney S. Ruoff et Hyoyoung Lee. (2010). Oxyde de graphène réduit par graphitisation chimique. DOI: 10.1038 / ncomms1067.



Personne n'a encore commenté ce post.