
Caractéristiques de l'acide et exemples

Les les acides ce sont des composés avec une forte tendance à donner des protons ou à accepter une paire d'électrons. Il existe de nombreuses définitions (Bronsted, Arrhenius, Lewis) qui caractérisent les propriétés des acides, et chacune d'elles est complétée pour construire une image globale de ce type de composés..
Dans la perspective ci-dessus, toutes les substances connues peuvent être acides, cependant, seules celles qui se distinguent bien au-dessus des autres sont considérées comme telles. En d'autres termes: si une substance est un donneur de protons extrêmement faible, par rapport à l'eau par exemple, on peut dire que ce n'est pas un acide.

Cela étant, quels sont exactement les acides et leurs sources naturelles? Un exemple typique d'entre eux peut être trouvé à l'intérieur de nombreux fruits: comme les agrumes. Les limonades ont leur saveur caractéristique due à l'acide citrique et à d'autres composants.
La langue peut détecter la présence d'acides, tout comme elle le fait avec d'autres saveurs. En fonction du niveau d'acidité de ces composés, le goût devient plus intolérable. De cette manière, la langue fonctionne comme un compteur organoleptique pour la concentration d'acides, en particulier la concentration d'ion hydronium (H3OU ALORS+).
D'autre part, les acides ne se trouvent pas seulement dans les aliments, mais aussi dans les organismes vivants. De même, les sols présentent des substances qui peuvent les caractériser comme acides; c'est le cas de l'aluminium et d'autres cations métalliques.
Index des articles
- 1 Caractéristiques des acides
- 1.1 - Propriétés physiques
- 1.2 - Capacité à générer des protons
- 1.3 - Ils ont des hydrogènes pauvres en densité électronique
- 1.4 - Constante de force ou d'acidité
- 1.5 - Il a des bases conjuguées très stables
- 1.6 - Ils peuvent avoir des charges positives
- 1.7 - Vos solutions ont des pH inférieurs à 7
- 1.8 - Capacité à neutraliser les bases
- 2 Acides forts et acides faibles
- 3 Exemples d'acides
- 3.1 Halogénures d'hydrogène
- 3.2 Oxoacides
- 3.3 Super acides
- 3.4 Acides organiques
- 4 Références
Caractéristiques des acides
Quelles caractéristiques un composé doit-il avoir, selon les définitions existantes, pour être considéré comme acide??
Doit être capable de générer des ions H+ et OH- lorsqu'il se dissout dans l'eau (Arrhenius), il doit donner des protons à d'autres espèces très facilement (Bronsted) ou enfin, il doit être capable d'accepter une paire d'électrons en se chargeant négativement (Lewis).
Cependant, ces caractéristiques sont étroitement liées à la structure chimique. Par conséquent, en apprenant à l'analyser, il est possible de déduire sa force d'acidité ou d'un couple de composés, lequel des deux est le plus acide..
- Propriétés physiques
Les acides ont une saveur qui vaut la redondance, l'acide et leur odeur brûle souvent les narines. Ce sont des liquides avec une texture collante ou huileuse et ont la capacité de changer la couleur du papier de tournesol et du méthylorange en rouge (Properties of Acids and Bases, S.F.).
- Capacité à générer des protons
En 1923, le chimiste danois Johannes Nicolaus Brønsted et le chimiste anglais Thomas Martin Lowry, ont introduit la théorie de Brønsted et Lowry déclarant que tout composé capable de transférer un proton vers n'importe quel autre composé est un acide (Encyclopædia Britannica, 1998). Par exemple dans le cas de l'acide chlorhydrique:
HCl → H+ + Cl-
La théorie de Brønsted et Lowry n'explique pas le comportement acide de certaines substances. En 1923, le chimiste américain Gilbert N.Lewis a introduit sa théorie, dans laquelle un acide est considéré comme tout composé qui, dans une réaction chimique, est capable de joindre une paire d'électrons non partagés dans une autre molécule (Encyclopædia Britannica, 1998).
De cette manière, des ions tels que Cudeux+, Foideux+ et la foi3+ Ils ont la capacité de se lier à des paires d'électrons libres, par exemple de l'eau pour produire des protons de la manière:
Cudeux+ + 2HdeuxO → Cu (OH)deux + 2H+
- Ils ont des hydrogènes pauvres en densité électronique
Pour la molécule de méthane, CH4, aucun de ses hydrogènes n'est électroniquement déficient. En effet, la différence d'électronégativité entre le carbone et l'hydrogène est très faible. Mais, si l'un des atomes H était remplacé par un atome de fluor, alors il y aurait un changement notable du moment dipolaire: HdeuxFC-H.
H il subit un déplacement de son nuage d'électrons vers l'atome adjacent lié au F, qui est le même, δ + augmente. Encore une fois, si un autre H est remplacé par un autre F, alors la molécule ressemblera à: HFdeuxC-H.
Maintenant δ + est encore plus élevé, car ce sont deux atomes F hautement électronégatifs, qui soustraient la densité électronique de C, et ce dernier, par conséquent, de C H. Si le processus de substitution se poursuivait, il serait finalement obtenu: F3C-H.
Dans cette dernière molécule H présente, du fait des trois atomes F voisins, un déficit électronique marqué. Ce δ + ne passe inaperçu par aucune espèce assez riche en électrons pour dépouiller ce H et donc F3CH devient chargé négativement:
F3C-H + : N- (espèce négative) => F3C:- + HN
L'équation chimique ci-dessus peut également être considérée de cette façon: F3CH fait don d'un proton (H+, les H une fois détaché de la molécule) a: N; de3CH gagne une paire d'électrons de H car une autre paire a été donnée à ce dernier par: N-.
- Force d'acidité ou constante
Combien de F3C:- est-il présent dans la solution? Ou, combien de molécules de F3CH peut donner de l'acide hydrogène à N? Pour répondre à ces questions, il est nécessaire de déterminer la concentration de F3C:- ou de HN et, à l'aide d'une équation mathématique, établissez une valeur numérique appelée constante d'acidité, Ka.
Le plus de molécules de F3C:- ou HN sont produits, plus il y aura d'acide F3CH et plus grand son Ka. De cette manière, Ka aide à clarifier, quantitativement, quels composés sont plus acides que d'autres; et, de même, il rejette comme acides ceux dont les Ka sont d'un ordre extrêmement petit.
Certains Ka peuvent avoir des valeurs autour de 10-1 et 10-5, et autres, les valeurs des millionièmes sont plus petites comme 10-quinze et 10-35. On peut alors dire que ces derniers, ayant lesdites constantes d'acidité, sont des acides extrêmement faibles et peuvent être rejetés en tant que tels..
Alors, laquelle des molécules suivantes a le Ka le plus élevé: CH4, CH3F, CHdeuxFdeux ou CHF3? La réponse réside dans le manque de densité électronique, δ +, dans leurs hydrogènes..
Des mesures
Mais quels sont les critères de standardisation des mesures Ka? Sa valeur peut varier énormément en fonction de l'espèce qui recevra le H+. Par exemple, si: N est une base forte, Ka sera grand; mais si, au contraire, c'est une base très faible, Ka sera petit.
Les mesures de Ka sont effectuées en utilisant la plus courante et la plus faible de toutes les bases (et acides): l'eau. En fonction du degré de don de H+ aux molécules HdeuxOu, à 25 ° C et à une pression d'une atmosphère, les conditions standard sont établies pour déterminer les constantes d'acidité de tous les composés.
De là découle un répertoire de tables de constantes d'acidité pour de nombreux composés, à la fois inorganiques et organiques..
- Il a des bases conjuguées très stables
Les acides ont des atomes ou unités hautement électronégatifs (cycles aromatiques) dans leurs structures chimiques qui attirent les densités d'électrons des hydrogènes environnants, les amenant ainsi à devenir partiellement positifs et réactifs à une base.
Une fois que les protons ont donné, l'acide se transforme en une base conjuguée; c'est-à-dire une espèce négative capable d'accepter H+ ou donnez une paire d'électrons. Dans l'exemple de la molécule CF3H sa base conjuguée est CF3-:
CF3- + HN <=> CHF3 + : N-
Oui CF3- est une base conjuguée très stable, l'équilibre sera plus décalé vers la gauche que vers la droite. De plus, plus il est stable, plus l'acide sera réactif et acide..
Comment savez-vous à quel point ils sont stables? Tout dépend de la façon dont ils gèrent la nouvelle charge négative. S'ils peuvent le délocaliser ou diffuser efficacement la densité électronique croissante, il ne sera pas disponible pour une utilisation en liaison avec la base H..
- Ils peuvent avoir des charges positives
Tous les acides n'ont pas d'hydrogènes déficients en électrons, mais ils peuvent aussi avoir d'autres atomes capables d'accepter des électrons, avec ou sans charge positive..
Comment est-ce? Par exemple, dans le trifluorure de bore, BF3, l'atome B manque d'un octet de valence, il peut donc former une liaison avec n'importe quel atome qui lui donne une paire d'électrons. Si un anion F- autour de sa proximité, la réaction chimique suivante se produit:
BF3 + F- => BF4-
D'autre part, les cations métalliques libres, tels que Al3+, Zndeux+, N / A+, etc., sont considérés comme acides, car à partir de leur environnement, ils peuvent accepter des liaisons datives (coordination) d'espèces riches en électrons. Ils réagissent également avec les ions OH- pour précipiter sous forme d'hydroxydes métalliques:
Zndeux+(aq) + 2OH-(ac) => Zn (OH)deux(s)
Tous ces derniers sont connus sous le nom d'acides de Lewis, tandis que ceux qui donnent des protons sont des acides de Bronsted..
- Leurs solutions ont des valeurs de pH inférieures à 7
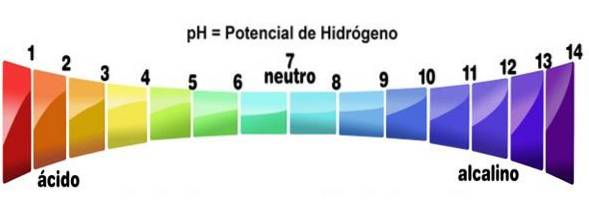
Plus précisément, lorsqu'un acide se dissout dans n'importe quel solvant (qui ne le neutralise pas sensiblement), il génère des solutions avec un pH inférieur à 3, bien qu'en dessous de 7, ils soient considérés comme des acides très faibles..
Cela peut être vérifié en utilisant un indicateur acide-base, tel que la phénolphtaléine, un indicateur universel ou du jus de chou violet. Les composés qui transforment les couleurs en celles indiquées pour un pH bas sont traités comme des acides. C'est l'un des tests les plus simples pour déterminer leur présence..
La même chose peut être faite, par exemple, pour différents échantillons de sol provenant de différentes parties du monde, déterminant ainsi leurs valeurs de pH pour, avec d'autres variables, les caractériser..
Et enfin, tous les acides ont des saveurs aigres, tant qu'ils ne sont pas suffisamment concentrés pour brûler de manière irréversible les tissus de la langue..
- Capacité à neutraliser les bases
Arrhenius, dans sa théorie, propose que les acides, en étant capables de générer des protons, réagissent avec l'hydroxyle des bases pour former du sel et de l'eau de la manière suivante:
HCl + NaOH → NaCl + HdeuxOU ALORS.
Cette réaction est appelée neutralisation et est à la base de la technique analytique appelée titrage (Bruce Mahan, 1990).
Acides forts et acides faibles
Les acides sont classés en acides forts et en acides faibles. La force d'un acide est associée à sa constante d'équilibre, par conséquent, dans le cas des acides, ces constantes sont appelées constantes d'acidité Ka.
Ainsi, les acides forts ont une grande constante d'acide et ont donc tendance à se dissocier complètement. Des exemples de ces acides sont l'acide sulfurique, l'acide chlorhydrique et l'acide nitrique, dont les constantes d'acide sont si grandes qu'elles ne peuvent pas être mesurées dans l'eau..
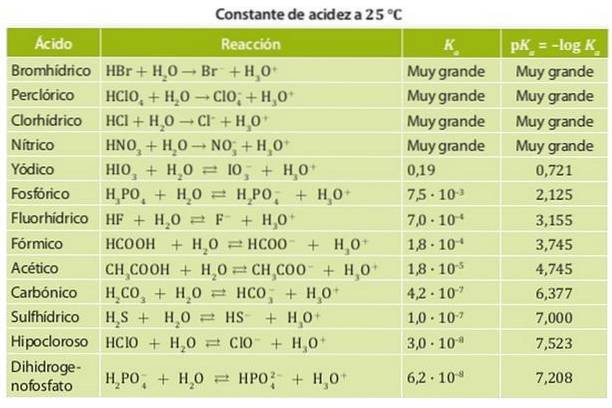
Par contre, un acide faible est un acide dont la constante de dissociation est faible et donc en équilibre chimique. Des exemples de ces acides sont l'acide acétique et l'acide lactique et l'acide nitreux dont les constantes d'acidité sont de l'ordre de 10-4. La figure 1 montre les différentes constantes d'acidité pour différents acides.
Exemples d'acides
Halogénures d'hydrogène
Tous les halogénures d'hydrogène sont des composés acides, en particulier lorsqu'ils sont dissous dans l'eau:
-HF (acide fluorhydrique).
-HCl (acide chlorhydrique).
-HBr (acide bromhydrique).
-HI (acide iodique).
Oxoacides
Les oxoacides sont les formes protonées des oxoanions:
HNO3 (acide nitrique).
HdeuxSW4 (acide sulfurique).
H3PO4 (acide phosphorique).
HClO4 (acide perchlorique).
Super acides
Les super acides sont le mélange d'un acide Bronsted fort et d'un acide fort de Lewis. Une fois mélangés, ils forment des structures complexes où, selon certaines études, le H+ "Saute" en eux.
Leur pouvoir corrosif est tel qu'ils sont des milliards de fois plus forts que HdeuxSW4 concentré. Ils sont utilisés pour craquer de grosses molécules présentes dans le pétrole brut, en molécules plus petites et ramifiées, et à forte valeur ajoutée économique..
-BF3/ HF
-SbF5/ HF
-SbF5/ HSO3F
-CF3SW3H
Acides organiques
Les acides organiques sont caractérisés en ce qu'ils ont un ou plusieurs groupes carboxyliques (COOH), et parmi eux se trouvent:
-Acide citrique (présent dans de nombreux fruits)
-Acide malique (de pommes vertes)
-Acide acétique (du vinaigre commercial)
-Acide butyrique (du beurre rance)
-Acide tartrique (issu des vins)
-Et la famille des acides gras.
Les références
- Torrens H. Acides et bases durs et mous. [PDF]. Extrait de: depa.fquim.unam.mx
- Helmenstine, Anne Marie, Ph.D. (3 mai 2018). Noms de 10 acides communs. Récupéré de: thinkco.com
- Chempages Netorials. Acides et bases: structure moléculaire et comportement. Tiré de: chem.wisc.edu
- Deziel, Chris. (27 avril 2018). Caractéristiques générales des acides et des bases. Découvrir. Récupéré de: scaimer.com
- Centre de calcul intensif de Pittsburgh (PSC). (25 octobre 2000). Récupéré de: psc.edu.


Personne n'a encore commenté ce post.