
Facteur de compressibilité comment calculer, exemples et exercices
le facteur de compressibilité Z, ou facteur de compression pour les gaz, est une valeur sans dimension (sans unités) qui est introduite en tant que correction dans l'équation d'état des gaz parfaits. De cette manière, le modèle mathématique ressemble plus étroitement au comportement observé du gaz..
Dans le gaz parfait, l'équation d'état qui se rapporte aux variables P (pression), V (volume) et T (température) est: P.V idéal = n.R.T avec n = nombre de moles et R = constante des gaz parfaits. En ajoutant la correction du facteur de compressibilité Z, cette équation devient:
P.V = Z.n.R.T
Index des articles
- 1 Comment calculer le facteur de compressibilité?
- 2 exemples
- 2.1 Le facteur de compressibilité dans les gaz parfaits, l'air, l'hydrogène et l'eau
- 3 exercices résolus
- 3.1 Exercice 1
- 3.2 Exercice 2
- 4 Références
Comment calculer le facteur de compressibilité?
En tenant compte du fait que le volume molaire est Vfrais = V / n, nous avons le volume molaire réel:
P . Vréel = Z. R. T → Z = PV réel/ RT
Le facteur de compressibilité Z dépendant des conditions du gaz, il est exprimé en fonction de la pression et de la température:
Z = Z (P, T)
En comparant les deux premières équations, on voit que si le nombre de moles n est égal à 1, le volume molaire d'un gaz réel est lié à celui du gaz parfait par:
Vréel / Vidéal = Z → V réel = Z Vidéal
Lorsque la pression dépasse 3 atmosphères, la plupart des gaz cessent de se comporter comme des gaz idéaux et le volume réel diffère considérablement de l'idéal..
Cela a été réalisé dans ses expériences par le physicien néerlandais Johannes Van der Waals (1837-1923), ce qui l'a conduit à créer un modèle mieux adapté aux résultats pratiques que l'équation du gaz idéal: l'équation d'état de Van. Der Waals.
Exemples
Selon l'équation P.Vréel= Z.n.RT, Pour un gaz parfait, Z = 1. Cependant, dans les gaz réels, à mesure que la pression augmente, la valeur de Z augmente également. Cela a du sens car plus la pression est élevée, les molécules de gaz ont plus de possibilités de collision, donc les forces répulsives augmentent et avec lui le volume.
En revanche, à des pressions plus faibles, les molécules se déplacent plus librement et les forces répulsives diminuent. Par conséquent, un volume plus faible est attendu. Quant à la température, lorsqu'elle augmente, Z diminue.
Comme l'a observé Van der Waals, au voisinage du point dit critique, le comportement du gaz s'écarte fortement de celui d'un gaz parfait..
Le point critique (Tc, Pc) de toute substance sont les valeurs de pression et de température qui déterminent son comportement avant un changement de phase:
-Tc est la température au-dessus de laquelle le gaz en question ne se liquéfie pas.
-Pc est la pression minimale requise pour liquéfier le gaz à la température Tc
Chaque gaz a cependant son propre point critique définissant la température et la pression réduite Tr Et Pr comme suit:
Pr = P / Pc
Vr = V / Vc
Tr = T / Tc
On observe qu'un gaz confiné avec des Vr Oui Tr exerce la même pression Pr. Pour cette raison, si Z est tracé en fonction de Pr à soi Tr, chaque point de cette courbe est le même pour n'importe quel gaz. C'est appelé principe des états correspondants.
Le facteur de compressibilité dans les gaz parfaits, l'air, l'hydrogène et l'eau
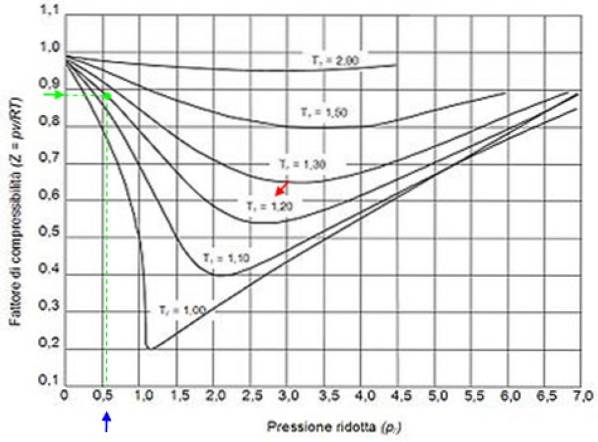
Vous trouverez ci-dessous une courbe de compressibilité pour divers gaz à diverses températures réduites. Voici quelques exemples de Z pour certains gaz et une procédure pour trouver Z en utilisant la courbe.
Gaz parfaits
Les gaz parfaits ont Z = 1, comme expliqué au début.
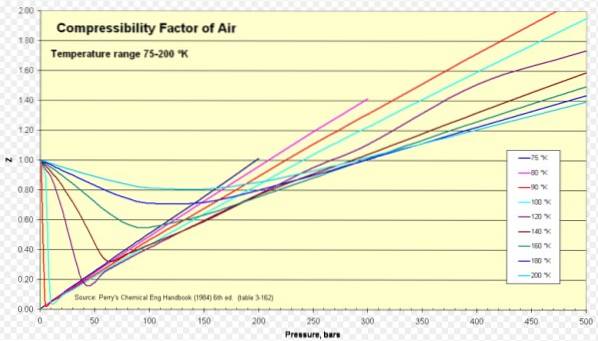
Air
Pour l'air, Z est d'environ 1 dans une large gamme de températures et de pressions (voir figure 1), où le modèle de gaz parfait donne de très bons résultats.
Hydrogène
Z> 1 pour toutes les pressions.
L'eau
Pour trouver Z pour l'eau, vous avez besoin des valeurs de points critiques. Le point critique de l'eau est: Pc = 22,09 MPa et Tc= 374,14 ° C (647,3 K). Là encore, il faut tenir compte du fait que le facteur de compressibilité Z dépend de la température et de la pression..
Par exemple, supposons que vous vouliez trouver Z d'eau à 500 ºC et 12 MPa. Ensuite, la première chose à faire est de calculer la température réduite, pour laquelle les degrés Celsius doivent être convertis en Kelvin: 50 ºC = 773 K:
Tr = 773 / 647,3 = 1,2
Pr = 12 / 22,09 = 0,54
Avec ces valeurs on place dans le graphe de la figure la courbe correspondant à Tr = 1,2, indiqué par une flèche rouge. Ensuite, nous cherchons la valeur de P sur l'axe horizontalr plus proche de 0,54, marqué en bleu. Maintenant, nous dessinons une verticale jusqu'à ce que nous interceptions la courbe Tr = 1,2 et enfin il est projeté de ce point sur l'axe vertical, où l'on lit la valeur approximative de Z = 0,89.
Exercices résolus
Exercice 1
Il existe un échantillon de gaz à une température de 350 K et une pression de 12 atmosphères, avec un volume molaire 12% supérieur à celui prédit par la loi des gaz parfaits. Calculer:
a) Facteur de compression Z.
b) Volume molaire de gaz.
c) D'après les résultats précédents, indiquez quelles sont les forces dominantes dans cet échantillon de gaz.
Données: R = 0,082 L.atm / mol.K
Solution pour
Sachant que V réel est 12% supérieur à Vidéal :
Vréel = 1,12 Vidéal
Z = V réel / Vidéal = 1,12
Solution b
P. Vréel = Z. R. T → Vréel = (1,12 x 0,082 x 350/12) L / mol = 2,14 L / mol.
Solution c
Les forces répulsives sont celles qui prédominent, puisque le volume de l'échantillon a augmenté.
Exercice 2
Il y a 10 moles d'éthane confinées dans un volume de 4,86 L à 27 ºC. Trouvez la pression exercée par l'éthane à partir de:
a) Le modèle du gaz parfait
b) L'équation de van der Waals
c) Trouvez le facteur de compression à partir des résultats précédents.
Données pour l'éthane
Coefficients de Van der Waals:
a = 5 489 dm6. au m. Môle-deux et b = 0,06380 dm3. Môle-1.
Pression critique: 49 atm. Température critique: 305 K
Solution pour
La température est passée au kelvin: 27 º C = 27 +273 K = 300 K, rappelez-vous également que 1 litre = 1 L = 1 dm3.
Ensuite, les données fournies sont remplacées dans l'équation des gaz parfaits:
P.V = n.R.T → P = (10 x 0,082 x 300 / 4,86 L) atm = 50,6 atm
Solution b
L'équation d'état de Van der Waals est:
Où a et b sont les coefficients donnés par l'énoncé. Lors de la suppression de P:
Solution c
Nous calculons la pression et la température réduites:
Pr = 35,2 / 49 = 0,72
Tr = 300/305 = 0,98 ≈ 1
Avec ces valeurs, nous recherchons la valeur de Z dans le graphique de la figure 2, constatant que Z est d'environ 0,7.
Les références
- Atkins, P. 1999. Chimie physique. Éditions Omega.
- Cengel, Y. 2012. Thermodynamique. 7ma Édition. Mcgraw Hill.
- Engel, T. 2007. Introduction à la physicochimie: thermodynamique. Pearson.
- Levine, I. 2014. Principes de physico-chimie. 6e. Édition. Mcgraw Hill.
- Wikipédia. Facteur de compressibilité. Récupéré de: en.wikipedia.org.



Personne n'a encore commenté ce post.