
Procédure d'électrolyse de l'eau, techniques, à quoi ça sert
La électrolyse de l'eau C'est la décomposition de l'eau en ses composants élémentaires par l'application d'un courant électrique. En procédant, l'hydrogène et l'oxygène moléculaire, Hdeux jedeux. Ces deux surfaces sont mieux connues sous le nom d'électrodes..
Théoriquement, le volume de Hdeux formé doit être deux fois le volume de Odeux. Parce que? Parce que la molécule d'eau a un rapport H / O égal à 2, c'est-à-dire deux H pour chaque oxygène. Cette relation est directement vérifiée avec sa formule chimique, HdeuxO. Cependant, de nombreux facteurs expérimentaux influencent les volumes obtenus.

Si l'électrolyse est réalisée à l'intérieur de tubes immergés dans l'eau (image du haut), la colonne d'eau inférieure correspond à l'hydrogène, car il y a une plus grande quantité de gaz exerçant une pression à la surface du liquide. Les bulles entourent les électrodes et finissent par monter après avoir surmonté la pression de vapeur de l'eau.
Notez que les tubes sont séparés les uns des autres de manière à ce qu'il y ait une faible migration de gaz d'une électrode à l'autre. À faible échelle, cela ne représente pas un risque imminent; mais à l'échelle industrielle, le mélange gazeux de Hdeux jedeux c'est très dangereux et explosif.
Pour cette raison, les cellules électrochimiques où s'effectue l'électrolyse de l'eau sont très coûteuses; Ils ont besoin d'une conception et d'éléments qui garantissent que les gaz ne se mélangent jamais, d'une alimentation électrique économique, de concentrations élevées d'électrolytes, d'électrodes spéciales (électrocatalyseurs) et de mécanismes pour stocker Hdeux produit.
Les électrocatalyseurs représentent le frottement et en même temps des ailes pour la rentabilité de l'électrolyse de l'eau. Certains sont constitués d'oxydes de métaux nobles, tels que le platine et l'iridium, dont les prix sont très élevés. C'est à ce stade surtout que les chercheurs unissent leurs forces pour concevoir des électrodes efficaces, stables et bon marché..
La raison de ces efforts est d'accélérer la formation d'Odeux, qui se produit à des vitesses inférieures par rapport à Hdeux. Ce ralentissement par l'électrode où se forme l'Odeux il entraîne comme conséquence générale l'application d'un potentiel beaucoup plus grand que nécessaire (surpotentiel); ce qui est pareil, à une performance moindre et des dépenses plus élevées.
Index des articles
- 1 Réaction d'électrolyse
- 1.1 Réactions demi-cellule
- 2 Procédure
- 3 techniques
- 3.1 Electrolyse avec de l'eau alcaline
- 3.2 Electrolyse avec membrane électrolytique polymère
- 3.3 Electrolyse avec des oxydes solides
- 4 À quoi sert l'électrolyse de l'eau?
- 4.1 Production d'hydrogène et ses utilisations
- 4.2 En tant que méthode de débogage
- 4.3 Comme alimentation en oxygène
- 5 Expérience à domicile
- 5.1 Variables d'origine
- 6 Références
Réaction d'électrolyse
L'électrolyse de l'eau comporte de nombreux aspects complexes. Cependant, de manière générale, sa base repose sur une simple réaction globale:
2HdeuxO (l) => 2Hdeux(g) + Odeux(g)
Comme le montre l'équation, deux molécules d'eau sont impliquées: l'une doit normalement être réduite ou gagner des électrons, tandis que l'autre doit s'oxyder ou perdre des électrons..
Le Hdeux C'est un produit de la réduction de l'eau, puisque le gain d'électrons favorise que les protons H+ peut se lier de manière covalente et l'oxygène est transformé en OH-. Par conséquent, le Hdeux se produit à la cathode, qui est l'électrode où la réduction se produit.
Alors que l'Odeux provient de l'oxydation de l'eau, grâce à laquelle elle perd les électrons qui lui permettent de se lier à l'hydrogène, et libère par conséquent des protons H+. Le Odeux il est produit à l'anode, l'électrode où se produit l'oxydation; et contrairement à l'autre électrode, le pH autour de l'anode est acide et non basique.
Réactions demi-cellule
Cela peut être résumé avec les équations chimiques suivantes pour les réactions demi-cellule:
2HdeuxO + 2e- => Hdeux + 2OH- (Cathode, basique)
2HdeuxO => Odeux + 4H+ + 4e- (Anode, acide)
Cependant, l'eau ne peut plus perdre d'électrons (4e-) dont l'autre molécule d'eau l'emporte à la cathode (2e-); par conséquent, la première équation doit être multipliée par 2, puis soustraite avec la deuxième équation pour obtenir l'équation nette:
2 (2HdeuxO + 2e- => Hdeux + 2OH-)
2HdeuxO => Odeux + 4H+ + 4e-
6HdeuxO => 2Hdeux + OU ALORSdeux + 4H+ + 4OH-
Mais 4H+ et 4OH- forme 4HdeuxOu, alors ceux-ci enlèvent quatre des six molécules de HdeuxOu en laissant deux; et le résultat est la réaction globale qui vient d'être soulevée.
Les réactions des demi-cellules changent avec les valeurs de pH, les techniques et ont également des potentiels de réduction ou d'oxydation associés, qui déterminent la quantité de courant nécessaire pour que l'électrolyse de l'eau se déroule spontanément..
Traiter
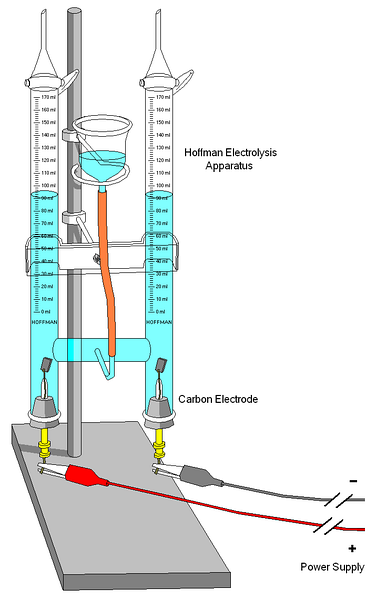
Un voltamètre Hoffman est montré dans l'image ci-dessus. Les cylindres sont remplis d'eau et des électrolytes sélectionnés par la buse du milieu. Le rôle de ces électrolytes est d'augmenter la conductivité de l'eau, car dans des conditions normales, il y a très peu d'ions H3OU ALORS+ et OH- produits de son auto-ionisation.
Les deux électrodes sont généralement en platine, bien que sur l'image elles aient été remplacées par des électrodes en carbone. Les deux sont connectés à une batterie, avec laquelle une différence de potentiel (ΔV) est appliquée qui favorise l'oxydation de l'eau (formation d'Odeux).
Les électrons parcourent tout le circuit jusqu'à ce qu'ils atteignent l'autre électrode, où l'eau les gagne et devient Hdeux et OH-. À ce stade, l'anode et la cathode sont déjà définies, ce qui peut être différencié par la hauteur des colonnes d'eau; celui avec la hauteur la plus basse, correspond à la cathode, où le H est formédeux.
Au sommet des cylindres, il y a des touches qui permettent de libérer les gaz générés. La présence de H peut être soigneusement vérifiéedeux le faisant réagir avec une flamme dont la combustion produit de l'eau gazeuse.
Techniques
Les techniques d'électrolyse de l'eau varient en fonction de la quantité de Hdeux jedeux qu'il est proposé de générer. Les deux gaz sont très dangereux s'ils sont mélangés ensemble, c'est pourquoi les cellules électrolytiques impliquent des conceptions complexes pour minimiser l'augmentation des pressions gazeuses et leur diffusion à travers le milieu aqueux..
De même, les techniques varient en fonction de la cellule, de l'électrolyte ajouté à l'eau et des électrodes elles-mêmes. D'autre part, certains impliquent que la réaction est effectuée à des températures plus élevées, réduisant la consommation d'électricité, et d'autres utilisent d'énormes pressions pour maintenir le Hdeux stockée.
Parmi toutes les techniques, on peut citer les trois suivantes:
Electrolyse avec de l'eau alcaline
L'électrolyse est réalisée avec des solutions basiques des métaux alcalins (KOH ou NaOH). Avec cette technique, les réactions se produisent:
4HdeuxO (l) + 4e- => 2Hdeux(g) + 4OH-(ac)
4OH-(ac) => Odeux(g) + 2HdeuxO (l) + 4e-
Comme on peut le voir, à la fois à la cathode et à l'anode, l'eau a un pH basique; et de plus, l'OH- migrent vers l'anode où ils s'oxydent en Odeux.
Electrolyse avec membrane électrolytique polymère
Cette technique utilise un polymère solide qui sert de membrane perméable pour H+, mais imperméable aux gaz. Cela garantit une plus grande sécurité lors de l'électrolyse..
Les réactions demi-cellule pour ce cas sont:
4H+(ac) + 4e- => 2Hdeux(g)
2HdeuxO (l) => Odeux(g) + 4H+(ac) + 4e-
Ions H+ migrent de l'anode vers la cathode, où ils sont réduits pour devenir Hdeux.
Electrolyse avec oxydes solides
Très différente des autres techniques, celle-ci utilise des oxydes comme électrolytes, qui à haute température (600-900 ° C) fonctionnent comme un moyen de transport de l'anion Odeux-.
Les réactions sont:
2HdeuxO (g) + 4e- => 2Hdeux(g) + 2Odeux-
2Odeux- => Odeux(g) + 4e-
Notez que cette fois ce sont les anions oxyde, Odeux-, ceux qui se déplacent vers l'anode.
À quoi sert l'électrolyse de l'eau?
L'électrolyse de l'eau produit Hdeux (g) et Odeux (g). Environ 5% de l'hydrogène gazeux produit dans le monde est produit par électrolyse de l'eau.
Le Hdeux c'est un sous-produit de l'électrolyse de solutions aqueuses de NaCl. La présence de sel facilite l'électrolyse en augmentant la conductivité électrique de l'eau.
La réaction globale qui a lieu est:
2NaCl + 2HdeuxO => Cldeux + Hdeux + 2NaOH
Pour comprendre l'énorme importance de cette réaction, certaines des utilisations des produits gazeux seront mentionnées; Car en fin de compte, ce sont eux qui conduisent le développement de nouvelles méthodes pour réaliser l'électrolyse de l'eau de manière plus efficace et plus verte.
De tous, le plus souhaité est de fonctionner comme des cellules qui remplacent énergiquement l'utilisation de combustibles fossiles..
Production d'hydrogène et ses utilisations
-L'hydrogène produit par électrolyse peut être utilisé dans l'industrie chimique agissant dans des réactions de dépendance, dans des processus d'hydrogénation ou comme agent réducteur dans des processus de réduction.
-De même, il est essentiel dans certaines actions d'importance commerciale, telles que: la production d'acide chlorhydrique, de peroxyde d'hydrogène, d'hydroxylamines, etc. Il est impliqué dans la synthèse de l'ammoniac par une réaction catalytique avec l'azote.
-En combinaison avec l'oxygène, il produit des flammes à forte teneur calorique, avec des températures comprises entre 3000 et 3500 K.Ces températures peuvent être utilisées pour le découpage et le soudage dans l'industrie métallurgique, pour la croissance de cristaux synthétiques, la production de quartz, etc..
-Traitement de l'eau: une teneur trop élevée en nitrates dans l'eau peut être réduite par son élimination dans des bioréacteurs, dans lesquels les bactéries utilisent l'hydrogène comme source d'énergie
-L'hydrogène est impliqué dans la synthèse des plastiques, du polyester et du nylon. De plus, il fait partie de la production de verre, augmentant la combustion lors de la cuisson..
-Réagit avec les oxydes et les chlorures de nombreux métaux, notamment: l'argent, le cuivre, le plomb, le bismuth et le mercure pour produire des métaux purs.
-De plus, il est utilisé comme carburant dans l'analyse chromatographique avec un détecteur de flamme..
En tant que méthode de débogage
L'électrolyse des solutions de chlorure de sodium est utilisée pour purifier l'eau de piscine. Lors de l'électrolyse, de l'hydrogène est produit à la cathode et du chlore (Cldeux) à l'anode. L'électrolyse est appelée dans ce cas un électrolyseur au sel.
Le chlore se dissout dans l'eau pour former de l'acide hypochloreux et de l'hypochlorite de sodium. L'acide hypochloreux et l'hypochlorite de sodium stérilisent l'eau.
En tant qu'apport d'oxygène
L'électrolyse de l'eau est également utilisée pour générer de l'oxygène sur la Station spatiale internationale, qui sert à maintenir une atmosphère d'oxygène dans la station..
L'hydrogène peut être utilisé dans une pile à combustible, une méthode pour stocker de l'énergie, et utiliser l'eau générée dans la cellule pour la consommation des astronautes.
Expérience à la maison
Des expériences d'électrolyse de l'eau ont été réalisées à l'échelle du laboratoire avec des voltmètres Hoffman, ou un autre assemblage permettant de contenir tous les éléments nécessaires d'une cellule électrochimique..
De tous les assemblages et équipements possibles, le plus simple peut être un grand réservoir d'eau transparent, qui servira de cellule. En plus de cela, toute surface métallique ou électriquement conductrice doit également être disponible pour fonctionner comme des électrodes; un pour la cathode et l'autre pour l'anode.
À cette fin, même des crayons avec des pointes en graphite pointues aux deux extrémités peuvent être utiles. Et enfin, une petite batterie et quelques câbles qui la relient aux électrodes improvisées..
Si elle n'est pas effectuée dans un récipient transparent, la formation de bulles gazeuses ne serait pas appréciée..
Variables d'accueil
Bien que l'électrolyse de l'eau soit un sujet qui contient de nombreux aspects intrigants et encourageants pour ceux qui recherchent des sources d'énergie alternatives, l'expérience à domicile peut être ennuyeuse pour les enfants et les autres spectateurs..
Par conséquent, une tension suffisante peut être appliquée pour générer la formation de Hdeux jedeux alterner certaines variables et noter les changements.
Le premier d'entre eux est la variation du pH de l'eau, en utilisant soit du vinaigre pour acidifier l'eau, soit du NadeuxCO3 pour le basifier légèrement. Un changement doit se produire dans le nombre de bulles observées.
De plus, la même expérience pourrait être répétée avec de l'eau chaude et froide. De cette manière, l'effet de la température sur la réaction serait alors considéré..
Enfin, pour rendre la collecte de données un peu moins incolore, une solution très diluée de jus de chou violet peut être utilisée. Ce jus est un indicateur acido-basique d'origine naturelle.
En l'ajoutant au récipient avec les électrodes insérées, on remarquera qu'à l'anode, l'eau deviendra rose (acide), tandis qu'à la cathode, la couleur sera jaune (basique).
Les références
- Wikipédia. (2018). Electrolyse de l'eau. Récupéré de: en.wikipedia.org
- Chaplin M. (16 novembre 2018). Electrolyse de l'eau. Structure de l'eau et science. Récupéré de: 1.lsbu.ac.uk
- Efficacité énergétique et énergie renouvelable. (s.f.). Production d'hydrogène: électrolyse. Récupéré de: energy.gov
- Phys.org. (14 février 2018). Catalyseur à haut rendement et à faible coût pour l'électrolyse de l'eau. Récupéré de: phys.org
- Chimie LibreTexts. (18 juin 2015). Electrolyse de l'eau. Récupéré de: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. et S. Lewis N. (2016). Principes et implémentations des systèmes d'électrolyse pour la division de l'eau. La Royal Society of Chemistry.
- Régents de l'Université du Minnesota. (2018). Electrolyse de l'eau 2. Université du Minnesota. Récupéré de: chem.umn.edu

Personne n'a encore commenté ce post.