
Formule de chlore gazeux, effets, utilisations et risques
le chlore gazeux (dichlor, chlore diatomique, chlore moléculaire ou simplement chlore) est un gaz jaune verdâtre, à l'odeur piquante et suffocante, non combustible à température ambiante et pression atmosphérique.
C'est l'élément avec la plus haute affinité électronique et la troisième plus haute électronégativité, derrière seulement l'oxygène et le fluor. Il est extrêmement réactif et un agent oxydant puissant.
Le potentiel oxydant élevé du chlore élémentaire a conduit au développement d'agents de blanchiment et de désinfectants commerciaux, ainsi que d'un réactif pour de nombreux procédés de l'industrie chimique..
Sous forme d'ions chlorure, le chlore est nécessaire à toutes les espèces de vie connues. Mais le chlore élémentaire en concentrations élevées est extrêmement dangereux et toxique pour tous les organismes vivants, c'est pourquoi il a été utilisé pendant la Première Guerre mondiale comme premier agent de guerre chimique gazeux..

Il est toxique par inhalation. L'inhalation à long terme de faibles concentrations ou à court terme de fortes concentrations de chlore gazeux a des effets néfastes sur la santé..
Les vapeurs sont beaucoup plus lourdes que l'air et ont tendance à se déposer dans les zones basses. Il ne brûle pas, mais soutient la combustion. Il est légèrement soluble dans l'eau. Le contact avec des liquides non confinés peut provoquer des gelures de refroidissement par évaporation.
Utilisé pour purifier l'eau, blanchir la pâte de bois et fabriquer d'autres produits chimiques.
Index des articles
- 1 formule
- 2 Structure 2D
- 3 caractéristiques
- 3.1 Propriétés physiques et chimiques
- 3.2 Alertes de réactivité
- 3.3 Inflammabilité
- 3.4 Réactivité
- 3.5 Toxicité
- 4 utilisations
- 5 Effets cliniques
- 6 Sécurité et risques
- 6.1 Classes de danger du SGH
- 6.2 Codes des conseils de prudence
- 7 Références
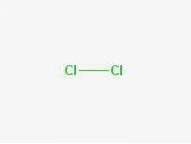
Formule
Formule: Cl-Cl
Numero CAS: 7782-50-5
Structure 2D

Caractéristiques
Proprietes physiques et chimiques

Le chlore gazeux appartient au groupe réactif des agents oxydants puissants. Ces composés réagissent souvent vigoureusement avec d'autres composés..
Le chlore gazeux appartient également au groupe réactif des agents halogénants puissants, qui transfèrent un ou plusieurs atomes d'halogène au composé avec lequel ils réagissent..
Les agents halogénants sont généralement acides et réagissent donc, dans certains cas violemment, avec les bases.
Beaucoup de ces composés sont réactifs à l'eau et réactifs à l'air. Les halogènes sont des oxydants très électronégatifs et puissants.
Alertes de réactivité
Le chlore gazeux est un puissant agent oxydant. Réagit avec l'eau. L'eau dissout le chlore gazeux, formant un mélange d'acide chlorhydrique et d'acides hypochloreux.
Inflammabilité
Il peut enflammer d'autres matériaux combustibles (bois, papier, huile, etc.). Le mélange avec des carburants peut provoquer une explosion. Le contenant peut exploser au contact du feu. Il existe un risque d'explosion (et d'empoisonnement) dû à l'accumulation de ses vapeurs à l'intérieur, dans les égouts ou à l'extérieur..
Les mélanges d'hydrogène et de chlore (5 à 95%) peuvent exploser sous l'action de presque toutes les formes d'énergie (chaleur, lumière du soleil, étincelles, etc.).
Il émet des fumées hautement toxiques lorsqu'il est chauffé. Lorsqu'il est combiné avec de l'eau ou de la vapeur, il produit des vapeurs d'acide chlorhydrique toxiques et corrosives.
Réactivité
Le chlore réagit de manière explosive avec (ou soutient la combustion de) de nombreux matériaux courants.
- Le chlore enflamme l'acier à 100 ° C en présence de suie, d'oxyde, de carbone ou d'autres catalyseurs.
- Allumez la laine d'acier sèche à 50 ° C.
- Allumer les sulfures à température ambiante.
- Allume (sous sa forme liquide) le caoutchouc naturel et synthétique.
- Allume les trialkylboranes et le dioxyde de tungstène.
- S'enflamme au contact de l'hydrazine, de l'hydroxylamine et du nitrure de calcium.
- S'enflamme ou explose avec l'arsine, la phosphine, le silane, le diborane, la stibine, le phosphore rouge, le phosphore blanc, le bore, le charbon actif, le silicium, l'arsenic.
- Provoque une inflammation et une légère explosion lors de la formation de bulles dans du méthanol froid.
- Explose ou s'enflamme s'il est excessivement mélangé avec de l'ammoniac et chauffé.
- Forme du trichlorure d'azote explosif au contact du réactif Biuret contaminé par l'acide cyanurique.
- Forme facilement des dérivés explosifs de N-chlore avec l'aziridine.
Le chlore (sous sa forme liquide ou gazeuse) réagit avec:
- Alcools (explosion)
- Aluminium fondu (explosion)
- Silanes (explosion)
- Pentafluorure de brome
- Disulfure de carbone (explosion catalysée par le fer)
- Chlore-2-propyne (l'excès de chlore provoque une explosion)
- Phtalate de dibutyle (explosion à 118 ° C)
- Éther diéthylique (allumé)
- Diéthyl zinc (allumé)
- Glycérol (explosion à 70-80 ° C)
- Méthane sur oxyde de mercure jaune (explosion)
- Acétylène (explosion déclenchée par la lumière du soleil ou la chaleur)
- Éthylène sur mercure, oxyde de mercure (I) ou oxyde d'argent (I) (explosion causée par la chaleur ou la lumière)
- Essence (réaction exothermique puis détonation)
- Mélange naphta-hydroxyde de sodium (explosion violente)
- Chlorure de zinc (réaction exothermique)
- Cire (explosion)
- Hydrogène (explosion déclenchée par la lumière)
- Carbure de fer
- Uranium et zirconium
- Hydrures de sodium, potassium et cuivre
- Étain
- Poudre d'aluminium
- Poudre de vanadium
- Feuille d'aluminium
- Clinquant
- Feuille de cuivre
- Poudre de calcium
- Fil de fer
- Poudre de manganèse
- Potassium
- Poudre d'antimoine
- Bismuth
- Germanium
- Magnésium
- Sodium
- Zinc
Toxicité
Le chlore gazeux est toxique et peut être mortel s'il est inhalé. Le contact peut provoquer des brûlures de la peau et des yeux, ainsi que des bronchites ou des affections pulmonaires chroniques..

Applications
Aujourd'hui, environ 15 000 composés chlorés sont utilisés dans le commerce. Le chlorure de sodium est de loin le composé chloré le plus courant et la principale source de chlore et d'acide chlorhydrique pour l'énorme industrie chimique du chlore..
De tout le chlore élémentaire produit, environ 63% est utilisé dans la fabrication de composés organiques, 18% dans la fabrication de composés chlorés inorganiques et les 19% restants du chlore produit sont utilisés pour les agents de blanchiment et les produits de désinfection..

Parmi les composés organiques les plus importants en termes de volume de production figurent le 1,2-dichloroéthane et le chlorure de vinyle (produits intermédiaires dans la production de PVC), le chlorure de méthyle, le chlorure de méthylène, le chloroforme, le chlorure de vinylidène, entre autres.
Les principaux composés inorganiques comprennent HCl, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SCl2, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl4 , ZnCl2 et bien d'autres.
Le chlore gazeux est utilisé dans les opérations de blanchiment industriel, le traitement des eaux usées, la fabrication de comprimés pour la chloration des piscines ou dans la guerre chimique.
Le chlore gazeux (connu sous le nom de bertholite), a été utilisé pour la première fois comme arme pendant la Première Guerre mondiale par l'Allemagne.
Après sa première utilisation, les deux parties au conflit ont utilisé le chlore comme arme chimique, mais il a été rapidement remplacé par le phosgène et le gaz moutarde, qui sont plus mortels..
Le chlore gazeux a également été utilisé pendant la guerre en Irak dans la province d'Anbar en 2007.
Effets cliniques
Le chlore gazeux est l'une des expositions professionnelles et environnementales à des irritants par inhalation unique les plus courantes. Estudios recientes han reportado que la mezcla de blanqueador (lejía, elaborada principalmente a base de hipoclorito de sodio) con otros productos de limpieza, es la causa más frecuente (21 % de los casos) de exposición única por inhalación reportada en los centros de toxicología des États-Unis.
Les principaux effets toxiques sont dus à des lésions tissulaires locales plutôt qu'à une absorption systémique. On pense que les lésions cellulaires résultent de l'oxydation des groupes fonctionnels sur les composants cellulaires; aux réactions avec l'eau dans les tissus pour former de l'acide hypochloreux et de l'acide chlorhydrique; et la génération de radicaux libres d'oxygène (bien que cette idée soit maintenant controversée).
En cas d'intoxication légère à modérée, il y a: toux, essoufflement, douleur thoracique, sensation de brûlure dans la gorge et dans la région rétrosternale, nausées ou vomissements, irritation oculaire et nasale, suffocation, faiblesse musculaire, étourdissements, inconfort abdominal et maux de tête.
En cas d'intoxication sévère, il y a: œdème des voies respiratoires supérieures, laryngospasme, œdème pulmonaire sévère, pneumonie, hypoxémie persistante, insuffisance respiratoire, lésion pulmonaire aiguë et acidose métabolique.
L'exposition chronique au chlore gazeux est l'une des causes les plus courantes d'asthme professionnel. Il peut provoquer une dyspnée, des palpitations, des douleurs thoraciques, un syndrome de dysfonctionnement réactif des voies respiratoires supérieures, une érosion de l'émail dentaire et une augmentation de la prévalence des syndromes viraux. Une exposition chronique à 15 ppm provoque une toux, une hémoptysie, des douleurs thoraciques et des maux de gorge.
L'exposition cutanée peut provoquer un érythème cutané, des douleurs, une irritation et des brûlures. Une exposition sévère peut provoquer un collapsus cardiovasculaire et un arrêt respiratoire. À des concentrations élevées, une syncope et une mort presque immédiate peuvent survenir. Le chlore (sous forme d'hypochlorite) est tératogène chez les animaux de laboratoire.
Sécurité et risques
Mentions de danger du Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH).
Le Système général harmonisé de classification et d'étiquetage des produits chimiques (SGH) est un système internationalement reconnu, créé par les Nations Unies et conçu pour remplacer les diverses normes de classification et d'étiquetage utilisées dans différents pays en utilisant des critères cohérents au niveau mondial (Nations Unies, 2015 ).
Les classes de danger (et leur chapitre GHS correspondant), les normes de classification et d'étiquetage et les recommandations pour le chlore gazeux sont les suivantes (Agence européenne des produits chimiques, 2017; Nations Unies, 2015; PubChem, 2017):
Classes de danger du SGH
H270: Peut provoquer ou aggraver un incendie; Comburant [Danger Gaz comburants - Catégorie 1]
H280: Contient un gaz sous pression; Peut exploser sous l'effet de la chaleur [Avertissement Gaz sous pression - Gaz comprimé, gaz liquéfié, gaz dissous]
H315: Provoque une irritation cutanée [Attention Corrosion cutanée / irritation cutanée - Catégorie 2]
H319: Provoque une sévère irritation des yeux [Attention Lésions oculaires graves / irritation oculaire - Catégorie 2A]
H330: Mortel par inhalation [Danger Toxicité aiguë, inhalation - Catégorie 1, 2]
H331: Toxique par inhalation [Danger Toxicité aiguë, inhalation - Catégorie 3]
H335: Peut irriter les voies respiratoires [Avertissement Toxicité spécifique pour certains organes cibles, exposition unique; Irritation des voies respiratoires - Catégorie 3]
H400: Très toxique pour les organismes aquatiques [Attention Dangereux pour le milieu aquatique, danger aigu - Catégorie 1]
H410: Très toxique pour les organismes aquatiques, entraîne des effets à long terme [Attention Dangereux pour le milieu aquatique, danger à long terme - Catégorie 1]
(PubChem, 2017)
Codes des conseils de prudence
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P313, P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 et P501.
Les références
- Benjah-bmm27 (2007). Dichlorine-gaz-3D-vdW [image]. Récupéré de: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [image]. Récupéré de: commons.wikimedia.org.
- ChemIDplus (2017) Structure 3D de 7782-50-5 - Chlore [image] Récupéré de: chem.nlm.nih.gov.
- Administration nationale des océans et de l'atmosphère (NOAA). Produits chimiques CAMEO. (2017). Fiche technique du groupe réactif. Agents oxydants, forts. Silver Spring, MD. UE; Récupéré de: cameochemicals.noaa.gov.
- Oelen, W., (2005). Chlore gazeux dans une bouteille [image]. Récupéré de: commons.wikimedia.org.
- Sargent, J., (1918). Gazé [image]. Récupéré de: en.wikipedia.org.
- Tomia (2006). Plastic-recyc-03 [image]. Récupéré de: commons.wikimedia.org.
- Wikipédia (2017). Chlore. Récupéré de: en.wikipedia.org.



Personne n'a encore commenté ce post.