
Structure, propriétés, utilisations du chlorure de chrome (CrCl3)
le chlorure de chrome (CrCl3) est un sel inorganique composé de cations Cr3+ et anions Cl- dans un rapport 1: 3; c'est-à-dire pour chaque Cr3+ il y a trois Cl-. Comme on le verra plus loin, leurs interactions ne sont pas ioniques. Ce sel peut se présenter sous deux formes: anhydre et hexahydraté..
La forme anhydre est caractérisée en ce qu'elle a une couleur violet rougeâtre; tandis que l'hexahydrate, CrCl3.6HdeuxOu, c'est vert foncé. L'incorporation des molécules d'eau modifie les propriétés physiques desdits cristaux; tels que leurs points d'ébullition et de fusion, leurs densités, etc..

Le chlorure de chrome (III) (selon la nomenclature de base) se décompose à haute température, se transformant en chlorure de chrome (II), CrCldeux. Il est corrosif pour les métaux, bien qu'il soit utilisé dans le chromage: une procédure dans laquelle les métaux sont recouverts d'une fine couche de chrome.
Le cr3+, Issu de son chlorure respectif, il a été utilisé dans le traitement du diabète, en particulier chez les patients en nutrition parentérale totale (TPN), qui n'ingèrent pas la quantité requise de chrome. Cependant, les résultats sont bien meilleurs (et plus fiables) s'ils sont fournis sous forme de picolinate..
Index des articles
- 1 Structure du chlorure de chrome
- 1.1 Couches cristallines d'anhydre
- 2 propriétés
- 2.1 Noms
- 2.2 Formule chimique
- 2.3 Poids moléculaire
- 2.4 Description physique
- 2.5 Point de fusion
- 2.6 Point d'ébullition
- 2.7 Solubilité dans l'eau
- 2.8 Solubilité dans les solvants organiques
- 2.9 Densité
- 2.10 Température de stockage
- 2.11 Décomposition
- 2.12 Corrosion
- 2.13 Réactions
- 2,14 pH
- 3 Synthèse
- 4 utilisations
- 4.1 Industriel
- 4.2 Thérapeutique
- 5 risques
- 6 Références
Structure de chlorure de chrome
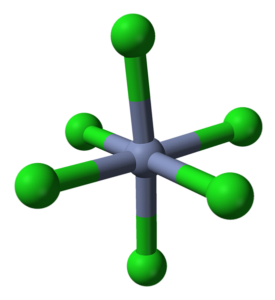
Le CrCl3 Bien qu'il s'agisse d'un sel, la nature de ses interactions ne sont pas purement ioniques; ont un certain caractère covalent, produit de la coordination entre Cr3+ et Cl-, qui donnent naissance à un octaèdre déformé (image du haut). Le chrome est situé au centre de l'octaèdre et le chlore dans ses sommets.
L'octaèdre CrCl6 peut, à première vue, contredire la formule CrCl3; cependant, cet octaèdre complet ne définit pas la maille élémentaire du cristal, mais plutôt un cube (également déformé), qui coupe les sphères vertes ou les anions de chlore en deux.
Couches cristallines anhydres
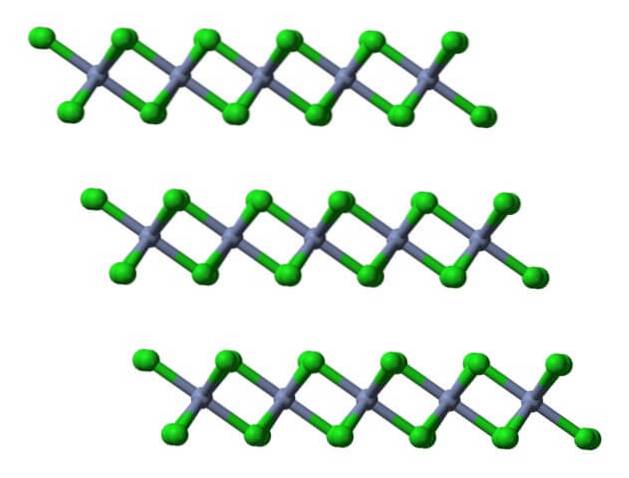
Ainsi, la cellule unitaire avec cet octaèdre maintient toujours le rapport 1: 3. En reproduisant ces cubes déformés dans l'espace, le cristal CrCl est obtenu3, qui est représenté dans l'image supérieure avec un modèle de remplissage tridimensionnel et un modèle de sphères et de barres.

Cette couche cristalline est l'une des nombreuses qui composent les cristaux violet rougeâtre floconneux de CrCl.3 (ne confondez pas la couleur du cristal, c'est vrai, avec celle des sphères vertes).
Comme on peut le voir, les anions Cl- ils occupent la surface, de sorte que leurs charges négatives repoussent les autres couches cristallines. Par conséquent, les cristaux deviennent floconneux et cassants; mais brillant, à cause du chrome.
Si ces mêmes couches sont visualisées d'un point de vue latéral, on observera, à la place des octaèdres, des tétraèdres déformés:
Ici, il est encore plus facile de comprendre pourquoi les couches se repoussent lorsque les anions Cl se lient.- de leurs surfaces.
Propriétés
Des noms
-Chlorure de chrome (III)
-Trichlorure de chrome (III)
-Chlorure de chrome (III) anhydre.
Formule chimique
-CrCl3 (anhydre).
-CrCl3.6HdeuxO (hexahydraté).
Poids moléculaire
-158,36 g / mol (anhydre).
-266,43 g / mol (hexahydraté).
Description physique
-Solides et cristaux violet rougeâtre (anhydre).
-Poudre cristalline vert foncé (hexahydratée, image du bas). Dans cet hydrate, on peut voir comment l'eau inhibe la brillance, une caractéristique métallique du chrome.

Point de fusion
-1,152 ºC (2,106 ºF, 1,425 K) (anhydre)
-83 ºC (hexahydraté).
Point d'ébullition
1300 ° C (2370 ° F, 1570) (anhydre).
Solubilité dans l'eau
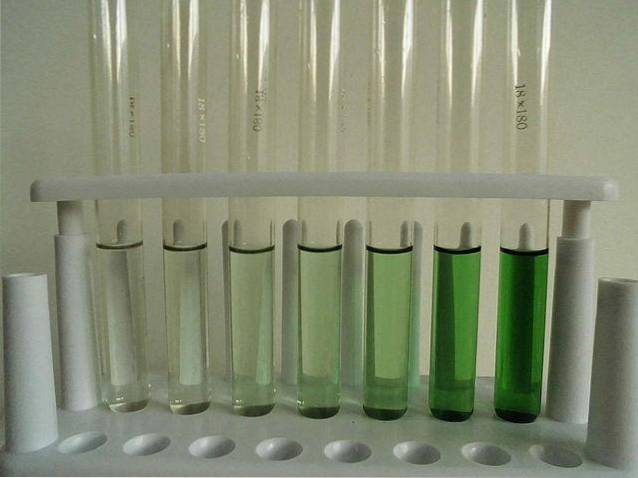
-Légèrement soluble (anhydre).
-585 g / L (hexahydraté).
L'image ci-dessus montre une série de tubes à essai remplis d'une solution aqueuse de CrCl3. A noter que plus il est concentré, plus la couleur du complexe est intense [Cr (OHdeux)6]3+, responsable de la couleur verte.
Solubilité dans les solvants organiques
Soluble dans l'éthanol, mais insoluble dans l'éther (anhydre).
Densité
-2,87 gr / cm3 (anhydre).
-2,76 g / cm3 (hexahydraté).
Température de stockage
Décomposition
Lorsqu'il est chauffé jusqu'à décomposition, le chlorure de chrome (III) émet des fumées toxiques de composés contenant du chlore. Ces composés sont également libérés lorsque le chlorure de chrome (III) entre en contact avec des acides forts..
Corrosion
Il est très corrosif et peut attaquer certains aciers.
Réactions
Il est incompatible avec les oxydants forts. Il réagit également fortement avec le lithium et l'azote..
Lorsqu'il est chauffé en présence d'hydrogène, il se réduit en chlorure de chrome (II), avec formation de chlorure d'hydrogène.
2 CrCl3 + Hdeux => 2 CrCldeux + 2 HCl
pH
En solution aqueuse, et à une concentration de 0,2 M: 2,4.
La synthèse
Le chlorure de chrome (III) hexahydraté est produit en faisant réagir de l'hydroxyde de chrome avec de l'acide chlorhydrique et de l'eau.
Cr (OH)3 + 3 HCl + 3 HdeuxO => CrCl3.6HdeuxOU ALORS
Ensuite, pour obtenir le sel anhydre, le CrCl est chauffé3.6HdeuxOu en présence de chlorure de thionyle, SOCldeux, acide chlorhydrique et chaleur:
[Cr (HdeuxOU ALORS)6] Cl3 + 6SOCldeux + ∆ → CrCl3 + 12 HCl + 6SOdeux
Alternativement, CrCl3 obtenu en faisant passer du chlore gazeux sur un mélange de chrome et d'oxyde de carbone.
CrdeuxOU ALORS3 + 3 C + Cldeux => 2 CrCl3 + 3 CO
Et enfin, étant la méthode la plus utilisée, il s'agit de chauffer son oxyde avec un agent halogénant, tel que le tétrachlorure de carbone:
CrdeuxOU ALORS3 + 3CCl4 + ∆ → 2CrCl3 + 3COCldeux
Applications
Industriel
Le chlorure de chrome est impliqué dans la préparation in situ du chlorure de chrome (II); réactif impliqué dans la réduction des halogénures d'alkyle et dans la synthèse des halogénures de (E) -alcényle.
-Il est utilisé dans la technique de chromage. Celle-ci consiste à déposer, par galvanoplastie, une fine couche de chrome sur des objets métalliques ou autre matériau à objectif décoratif, augmentant ainsi la résistance à la corrosion et également la dureté de surface..
-Il est utilisé comme mordant textile, servant de lien entre le matériau de teinture et les tissus à teindre. De plus, il est utilisé comme catalyseur pour la production d'oléfines et d'agents imperméabilisants..
Thérapeutique
L'utilisation d'un supplément de chlorure de chrome USP est recommandée chez les patients qui ne reçoivent que des solutions intraveineuses, administrées pour la nutrition parentérale totale (TPN). Par conséquent, uniquement lorsque ces patients ne reçoivent pas tous leurs besoins nutritionnels.
Le chrome (III) fait partie du facteur de tolérance au glucose, un activateur des réactions favorisant l'insuline. On pense que le chrome (III) active le métabolisme du glucose, des protéines et des lipides, facilitant l'action de l'insuline chez l'homme et l'animal.
Le chrome est présent dans de nombreux aliments. Mais sa concentration ne dépasse pas 2 par portion, le brocoli étant l'aliment le plus contributif (11 µg). De plus, l'absorption intestinale du chrome est faible, avec une valeur de 0,4 à 2,5% de la quantité ingérée..
Cela rend difficile l'établissement d'un régime pour l'approvisionnement en chrome. En 1989, la National Academy of Sciences recommandait 50 à 200 µg / jour comme apport adéquat de chrome..
Des risques
Parmi les risques possibles de la consommation de ce sel comme supplément de chrome, on trouve:
-Douleurs d'estomac sévères.
-Saignement anormal, qui peut aller de la difficulté à guérir une plaie, des ecchymoses plus rouges ou un assombrissement des selles dû à un saignement interne.
-Irritations du système digestif, provoquant des ulcères dans l'estomac ou les intestins.
-Dermatite
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Chlorure de chrome (III). Récupéré de: en.wikipedia.org
- Chlorure de chrome (III) [PDF]. Récupéré de: alpha.chem.umb.edu
- PubChem. (2019). Chlorure de chrome hexahydraté. Récupéré de: pubchem.ncbi.nlm.nih.gov
- Instituts nationaux de la santé. (21 septembre 2018). Chrome: Fiche d'information sur les compléments alimentaires. Récupéré de: ods.od.nih.gov
- Tomlinson Carole A. (2019). Effets secondaires du chlorure de chrome. Leaf Group Ltd. Récupéré de: healthfully.com



Personne n'a encore commenté ce post.