
Qu'est-ce que la volatilisation?

La volatilisation est le processus de conversion d'une substance chimique d'un état liquide ou solide à un état gazeux ou vapeur. Les autres termes utilisés pour décrire le même processus sont la vaporisation, la distillation et la sublimation..
Une substance peut souvent être séparée d'une autre par volatilisation et peut ensuite être récupérée par condensation de vapeur..

La substance peut être volatilisée plus rapidement soit en la chauffant pour augmenter sa pression de vapeur, soit en éliminant la vapeur à l'aide d'un courant de gaz inerte ou d'une pompe à vide..
Les procédures de chauffage comprennent la volatilisation de l'eau, du mercure ou du trichlorure d'arsenic pour séparer ces substances des éléments interférents..
Des réactions chimiques sont parfois utilisées pour produire des produits volatils comme dans la libération de dioxyde de carbone des carbonates, de l'ammoniac dans la méthode Kjeldahl pour la détermination de l'azote et du dioxyde de soufre dans la détermination du soufre dans l'acier.
Les méthodes de volatilisation se caractérisent généralement par une grande simplicité et facilité d'utilisation, sauf lorsque des températures élevées ou des matériaux hautement résistants à la corrosion sont nécessaires (Louis Gordon, 2014).
Volatilisation de la pression de vapeur
Sachant que la température d'ébullition de l'eau est de 100 ° C, vous êtes-vous déjà demandé pourquoi l'eau de pluie s'évapore??
Est-ce 100 ° C? Si oui, pourquoi est-ce que je ne me réchauffe pas? Vous êtes-vous déjà demandé ce qui donne l'arôme caractéristique de l'alcool, du vinaigre, du bois ou du plastique? (Pression de vapeur, S.F.)
Responsable de tout cela est une propriété connue sous le nom de pression de vapeur, qui est la pression exercée par une vapeur en équilibre avec la phase solide ou liquide de la même substance..
Aussi, la pression partielle de la substance dans l'atmosphère sur le solide ou le liquide (Anne Marie Helmenstine, 2014).
La pression de vapeur est une mesure de la tendance d'un matériau à passer à l'état gazeux ou vapeur, c'est-à-dire une mesure de la volatilité des substances.
Au fur et à mesure que la pression de vapeur augmente, plus la capacité du liquide ou du solide à s'évaporer est grande, devenant ainsi plus volatile..
La pression de vapeur augmentera avec la température. La température à laquelle la pression de vapeur à la surface d'un liquide est égale à la pression exercée par l'environnement s'appelle le point d'ébullition du liquide (Encyclopædia Britannica, 2017).
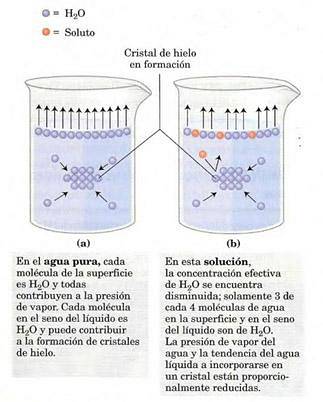
La pression de vapeur dépendra du soluté dissous dans la solution (c'est une propriété colligative). A la surface de la solution (interface air-gaz) les molécules les plus superficielles ont tendance à s'évaporer, à s'échanger entre les phases et à générer une pression de vapeur..
La présence de soluté diminue le nombre de molécules de solvant à l'interface, réduisant la pression de vapeur..
Le changement de pression de vapeur peut être calculé avec la loi de Raoult pour les solutés non volatils qui est donnée par:
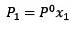
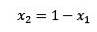
Où X2 est la fraction molaire du solvant. Si nous multiplions les deux côtés de l'équation par P °, alors il reste:
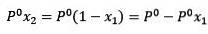
Remplacer (1) dans (3) est:
(4)
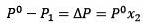
Il s'agit de la variation de la pression de vapeur lorsqu'un soluté se dissout (Jim Clark, 2017).
Analyse gravimétrique
L'analyse gravimétrique est une classe de techniques de laboratoire utilisées pour déterminer la masse ou la concentration d'une substance en mesurant un changement de masse..
Le produit chimique que nous essayons de quantifier est parfois appelé analyte. Nous pourrions utiliser l'analyse gravimétrique pour répondre à des questions telles que:
- Quelle est la concentration de l'analyte dans une solution?
- Quelle est la pureté de notre échantillon? L'échantillon ici pourrait être un solide ou en solution.
Il existe deux types courants d'analyse gravimétrique. Les deux impliquent de changer la phase de l'analyte pour le séparer du reste d'un mélange, entraînant un changement de masse..
L'une de ces méthodes est la gravimétrie des précipitations, mais celle qui nous intéresse vraiment est la gravimétrie par volatilisation..
La gravimétrie de volatilisation est basée sur la décomposition thermique ou chimique de l'échantillon et la mesure du changement résultant de sa masse..
Alternativement, nous pouvons attraper et peser un produit de décomposition volatil. Parce que la libération d'une espèce volatile est une partie essentielle de ces méthodes, nous les classons collectivement comme des méthodes d'analyse gravimétrique de volatilisation (Harvey, 2016).
Les problèmes d'analyse gravimétrique sont simplement des problèmes de stoechiométrie avec quelques étapes supplémentaires.
Pour effectuer tout calcul stoechiométrique, nous avons besoin des coefficients de l'équation chimique équilibrée.
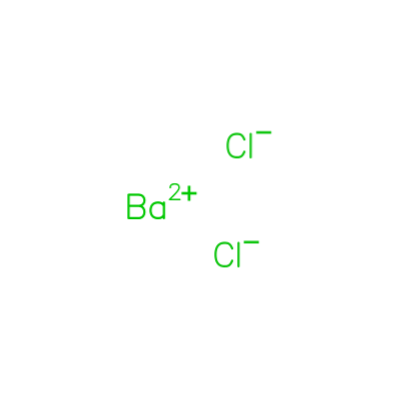
Par exemple, si un échantillon contient du chlorure de baryum dihydraté (BaCldeux● HdeuxO), la quantité d'impuretés peut être obtenue en chauffant l'échantillon pour évaporer l'eau.
La différence de masse entre l'échantillon d'origine et l'échantillon chauffé nous donnera, en grammes, la quantité d'eau contenue dans le chlorure de baryum.
Avec un simple calcul stoechiométrique, la quantité d'impuretés dans l'échantillon sera obtenue (Khan, 2009).
Distillation fractionnée
La distillation fractionnée est un processus par lequel les composants d'un mélange liquide sont séparés en différentes parties (appelées fractions) en fonction de leurs différents points d'ébullition.
La différence de volatilité des composés dans le mélange joue un rôle fondamental dans leur séparation..
La distillation fractionnée est utilisée pour purifier les produits chimiques et également pour séparer les mélanges pour obtenir leurs composants. Il est utilisé comme technique de laboratoire et dans l'industrie, où le procédé est d'une grande importance commerciale.
Les vapeurs d'une solution bouillante passent à travers une colonne haute, appelée colonne de fractionnement..
La colonne est remplie de billes de plastique ou de verre pour améliorer la séparation en offrant plus de surface pour la condensation et l'évaporation.
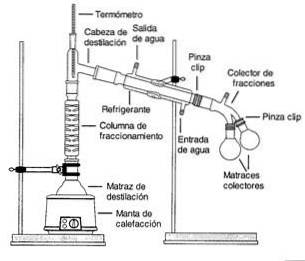
La température de la colonne diminue progressivement sur sa longueur. Les composants avec un point d'ébullition plus élevé se condensent dans la colonne et retournent à la solution.
Les composants avec des points d'ébullition inférieurs (plus volatils) passent à travers la colonne et sont collectés près du sommet.
Théoriquement, avoir plus de billes ou de plaques améliore la séparation, mais l'ajout de plaques augmente également le temps et l'énergie nécessaires pour terminer une distillation (Helmenstine, 2016)..
Les références
- Anne Marie Helmenstine. (2014, 16 mai). Définition de la pression de vapeur. Récupéré de thinkco.com.
- Encyclopædia Britannica. (2017, 10 février). La pression de vapeur. Récupéré de britannica.com.
- Harvey, D. (25 mars 2016). Gravimétrie de volatilisation. Récupéré de chim.libretexts.
- Helmenstine, A. M. (8 novembre 2016). Définition et exemples de distillation fractionnée. Récupéré de thinkco.com.
- Jim Clark, I. L. (3 mars 2017). Loi de Raoult. Récupéré de chim.libretexts.
- Khan, S. (27 août 2009). Introduction à l'analyse gravimétrique: gravimétrie par volatilisation. Récupéré de la khanacademy.
- Louis Gordon, R. W. (2014). Récupéré de accessscience.com.
- La pression de vapeur. (S.F.). Récupéré de chem.purdue.edu.


Personne n'a encore commenté ce post.