
À quoi sert le tableau périodique? 7 utilisations importantes

La table périodique Il sert à montrer les relations entre les différents éléments; Il peut également être utilisé pour prédire les propriétés de nouveaux éléments encore découverts ou non encore synthétisés..
Il donne des informations et des données sur les groupes, les éléments, la masse atomique, l'énergie d'ionisation, la configuration électronique, le numéro atomique, l'électronégativité et les états d'oxydation. Le tableau périodique fournit également un cadre utile pour analyser le comportement chimique; Il est largement utilisé dans le domaine de la chimie et dans de nombreuses autres sciences.
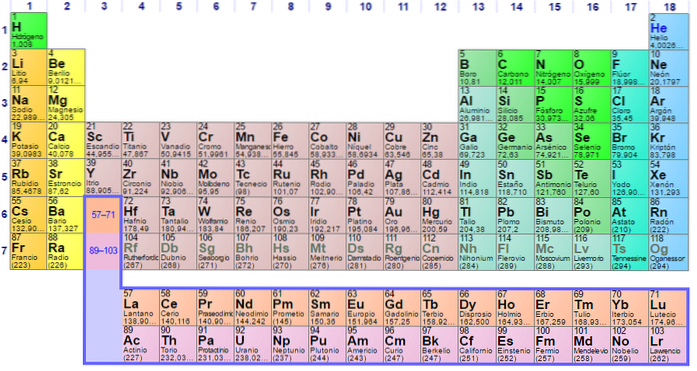
Il a été construit en 1869 par le scientifique russe Dmitri Ivanovich Mendeleev pour visualiser les différentes relations entre les différents éléments chimiques.
Le tableau périodique est ordonné par son numéro atomique, ses configurations électroniques et ses propriétés chimiques récurrentes. Il est également ordonné de manière à ce que les éléments ayant des comportements similaires soient dans la même colonne.
Le tableau comporte quatre blocs rectangulaires avec des propriétés chimiques similaires. Généralement, les éléments situés sur le côté gauche d'une rangée sont des métaux, et les non-métaux sont situés sur la droite.
Les éléments sont situés sur le tableau périodique en fonction de leur structure atomique. Chaque ligne et chaque colonne ont des caractéristiques spéciales.
Toutes les lignes du tableau sont lues de gauche à droite et chaque ligne est appelée point. Chaque colonne du tableau est appelée un groupe. Chaque groupe du tableau a le même nombre d'électrons.
Il est facile de trouver le nombre d'électrons dans la coque externe de chaque élément du tableau. Le groupe un a un électron, le groupe deux en a deux, et ainsi de suite.
Un bon tableau périodique est un excellent outil pour la résolution de problèmes en chimie. Les tableaux périodiques peuvent être trouvés sur le Web ou ils peuvent être imprimés.
Utilisations du tableau périodique à quoi ça sert?
Connaître le symbole de l'élément chimique
Les symboles sont des abréviations pour le nom de l'élément. Dans de nombreux cas, l'abréviation provient du nom latin d'origine.
Chaque symbole a une ou deux lettres comme abréviation. Habituellement, le symbole est une abréviation du nom de l'élément mais certains symboles font référence aux anciens noms des éléments.
Un exemple de ce cas est l'argent; son symbole est Ag, qui fait référence à son ancien nom qui était argentum.
Connaître le numéro atomique de l'élément
C'est le nombre de protons qu'un atome de cet élément contient. Le nombre de protons est le facteur décisif lorsqu'il s'agit de distinguer un élément d'un autre. La variation du nombre d'électrons ou de neutrons ne change pas le type d'élément.
Les changements du nombre d'électrons produisent des ions, tandis que les changements du nombre de neutrons produisent des isotopes. Le tableau périodique moderne est organisé par ordre croissant de numéro atomique.
Identifier ce que signifient les périodes et les groupes du tableau périodique
Les lignes horizontales sont appelées périodes. Chaque période indique le niveau d'énergie le plus élevé que chacun des électrons de cet élément occupe dans son état de base..
Les colonnes verticales sont appelées groupes. Chaque élément d'un groupe a le même nombre d'électrons de valence et ils se comportent généralement de manière similaire lorsqu'ils sont liés à d'autres éléments..
Les deux dernières rangées, les lanthanides et les actinides, appartiennent au groupe 3B et sont listées séparément..
Connaître le nom de l'élément
De nombreux tableaux périodiques incluent également le nom complet de l'élément. Ceci est utile lorsqu'il s'agit de connaître un élément car vous ne pouvez pas toujours vous souvenir des symboles de tous les éléments.
Se familiariser avec la masse atomique de l'élément en unités de masse atomique
Ce nombre fait référence à la masse lourde moyenne des isotopes d'un élément chimique. Le tableau périodique original de Mendeleev était organisé de manière à ce que les éléments soient affichés par ordre croissant de masse atomique ou de poids..
Identifier les types d'éléments
De nombreux tableaux périodiques identifient différents types d'éléments en utilisant différentes couleurs pour différents types d'éléments.
Ces types comprennent les métaux alcalins, les métaux de base, les métaux de transition, les non-métaux, les gaz nobles, les allogènes, les alcalino-terreux, les semi-métaux, les actinides et les lanthanides..
Afficher les différentes tendances (périodicité)
Le tableau périodique est organisé pour montrer les différents types de tendance (périodicité). Entre elles:
- Le rayon atomique, qui correspond à la moitié de la distance entre les centres de deux atomes qui se touchent à peine:
- Il augmente à mesure que vous vous déplacez du haut vers le bas du tableau périodique.
- Il descend en se déplaçant de gauche à droite dans le tableau périodique.
- Énergie d'ionisation, qui est l'énergie nécessaire pour éliminer un électron de l'atome.
- Il descend à mesure qu'il monte et descend dans le tableau périodique.
- Augmente à mesure que vous vous déplacez de gauche à droite sur le tableau périodique.
- Électronégativité, qui mesure la capacité à former une liaison chimique.
- Il descend en montant et en descendant.
- Augmente lorsque vous vous déplacez de gauche à droite.
- L'affinité électronique, qui fait référence à la capacité de l'élément à accepter un électron.
L'affinité électronique peut être prédite sur la base des groupes d'éléments. Les gaz nobles, tels que l'argon et le néon, ont une affinité électronique presque nulle et ont tendance à ne pas accepter d'électrons..
Les halogènes, comme le chlore et l'iode, ont des affinités électroniques élevées. La plupart des autres groupes d'éléments ont des affinités électroniques inférieures à celles des allogènes, mais bien supérieures à celles des gaz rares..
Les références
- Quel est le but du tableau périodique? Récupéré de reference.com
- Comment utiliser un tableau périodique (2017) Récupéré de thinkco.com
- Comment les éléments du tableau périodique sont-ils organisés? Récupéré de reference.com
- Tableau périodique. Récupéré de wikipeda.org
- Pourquoi le tableau périodique est-il utile? Récupéré de reference.com



Personne n'a encore commenté ce post.