
Pièces de cellule électrolytique, fonctionnement et applications
La cellule électrolytique c'est un milieu dans lequel l'énergie ou un courant électrique est utilisé pour effectuer une réaction de réduction d'oxyde non spontanée. Il se compose de deux électrodes: l'anode et la cathode.
À l'anode (+), une oxydation se produit, car à ce site, certains éléments ou composés perdent des électrons; tandis que dans la cathode (-), la réduction, car en elle certains éléments ou composés gagnent des électrons.
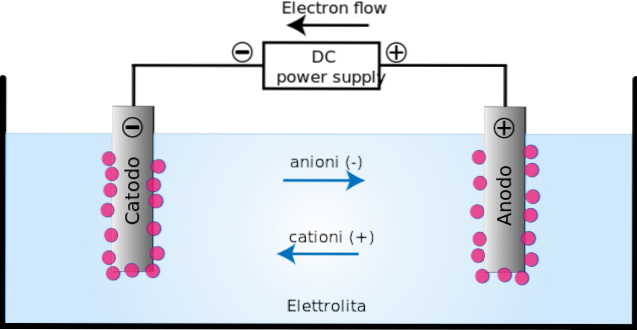
Dans la cellule électrolytique, la décomposition de certaines substances, auparavant ionisées, se produit par un processus appelé électrolyse..
L'application du courant électrique produit une orientation dans le mouvement des ions dans la cellule électrolytique. Les ions chargés positivement (cations) migrent vers la cathode de charge (-).
Pendant ce temps, les ions (anions) chargés négativement migrent vers l'anode chargée (+). Ce transfert de charge constitue un courant électrique (image du haut). Dans ce cas, le courant électrique est conduit par des solutions d'électrolyte, présentes dans le conteneur de la cellule électrolytique..
La loi d'électrolyse de Faraday stipule que la quantité de substance qui subit une oxydation ou une réduction à chaque électrode est directement proportionnelle à la quantité d'électricité qui passe à travers la cellule ou la cellule..
Index des articles
- 1 pièces
- 2 Comment fonctionne une cellule électrolytique?
- 2.1 Electrolyse du chlorure de sodium fondu
- 2.2 Cellule inférieure
- 3 applications
- 3.1 Synthèses industrielles
- 3.2 Revêtement et affinage des métaux
- 4 Références
les pièces
Une cellule électrolytique est constituée d'un conteneur où se dépose le matériau qui va subir les réactions induites par la charge électrique..
Le conteneur a une paire d'électrodes qui sont connectées à une batterie à courant continu. Les électrodes habituellement utilisées sont constituées d'un matériau inerte, c'est-à-dire qu'elles ne participent pas aux réactions.
Un ampèremètre peut être connecté en série avec la batterie pour mesurer l'intensité du courant traversant la solution électrolytique. De même, un voltmètre est placé en parallèle pour mesurer la différence de tension entre la paire d'électrodes..
Comment fonctionne une cellule électrolytique?
Électrolyse du chlorure de sodium fondu
Il est préférable d'utiliser du chlorure de sodium fondu plutôt que du chlorure de sodium solide, car ce dernier ne conduit pas l'électricité. Les ions vibrent dans vos cristaux, mais ils ne sont pas libres de bouger.
Réaction cathodique
Des électrodes en graphite, un matériau inerte, sont connectées aux bornes de la batterie. Une électrode est connectée à la borne positive de la batterie, constituant l'anode (+).
Pendant ce temps, l'autre électrode est connectée à la borne négative de la batterie, constituant la cathode (-). Lorsque le courant circule de la batterie, ce qui suit est observé:
A la cathode (-) il y a une réduction de l'ion Na+, qui, lors de l'obtention d'un électron, se transforment en Na métallique:
N / A+ + et- => Na (l)
Le sodium métallique blanc argenté flotte au-dessus du chlorure de sodium fondu.
Réaction anodique
Au contraire, l'oxydation de l'ion Cl se produit à l'anode (+)-, car il perd des électrons et devient du chlore gazeux (Cldeux), un processus qui se manifeste par l'apparition à l'anode d'un gaz vert pâle. La réaction qui se produit à l'anode peut être décrite comme suit:
2Cl- => Cldeux (g) + 2 e-
La formation de gaz métalliques Na et Cldeux à partir de NaCl, ce n'est pas un processus spontané, nécessitant des températures supérieures à 800 ° C pour qu'il se produise. Le courant électrique fournit l'énergie pour que la transformation indiquée se produise au niveau des électrodes de la cellule électrolytique..
Les électrons sont consommés à la cathode (-) dans le processus de réduction et sont produits à l'anode (+) lors de l'oxydation. Par conséquent, les électrons circulent à travers le circuit externe de la cellule électrolytique de l'anode à la cathode..
La batterie à courant continu fournit l'énergie pour que les électrons circulent de manière non spontanée de l'anode (+) à la cathode (-).
Down Cell
La cellule Down est une adaptation de la cellule électrolytique décrite et utilisée pour la production industrielle de Na métallique et de chlore gazeux..
La cellule électrolytique de Down possède des dispositifs qui permettent la collecte, séparément, du sodium métallique et du chlore gazeux. Cette méthode de production de sodium métallique est encore très pratique.
Une fois libéré par électrolyse, le sodium métallique liquide est drainé, refroidi et découpé en blocs. Par la suite, il est stocké dans un milieu inerte, car le sodium peut réagir de manière explosive au contact de l'eau ou de l'oxygène atmosphérique..
Le chlore gazeux est produit dans l'industrie, principalement, par électrolyse du chlorure de sodium dans un procédé moins coûteux que la production de sodium métallique.
Applications
Synthèses industrielles
-Dans l'industrie, les cellules électrolytiques sont utilisées dans l'électroraffinage et la galvanoplastie de divers métaux non ferreux. La quasi-totalité de l'aluminium, du cuivre, du zinc et du plomb de haute pureté sont produits industriellement dans des cellules électrolytiques..
-L'hydrogène est produit par électrolyse de l'eau. Cette procédure chimique est également utilisée pour obtenir de l'eau lourde (DdeuxOU ALORS).
-Des métaux comme Na, K et Mg sont obtenus par électrolyse d'électrolytes fondus. En outre, les non-métaux comme les fluorures et les chlorures sont obtenus par électrolyse. En outre, des composés comme NaOH, KOH, NadeuxCO3 et KMnO4 sont synthétisés selon la même procédure.
Revêtement et affinage des métaux
-Le processus de revêtement d'un métal inférieur avec un métal de meilleure qualité est connu sous le nom de galvanoplastie. Le but de ceci est d'empêcher la corrosion du métal inférieur et de le rendre plus attrayant. Les cellules électrolytiques sont utilisées dans la galvanoplastie à cet effet..
-Les métaux impurs peuvent être raffinés par électrolyse. Dans le cas du cuivre, des feuilles de métal très fines sont placées sur la cathode et de grandes tiges de cuivre impur à affiner sur l'anode.
-L'utilisation d'articles plaqués est courante dans la société. Les bijoux et la vaisselle sont généralement plaqués argent; l'or est électrodéposé sur les bijoux et les contacts électriques. De nombreux objets sont recouverts de cuivre à des fins décoratives.
-Les voitures ont des ailes en acier chromé et d'autres pièces. Le chromage d'un pare-chocs de voiture ne prend que 3 secondes de chromage pour produire une surface brillante de 0,0002 mm d'épaisseur.
-L'électrodéposition rapide du métal produit des surfaces rugueuses et noires. Une électrodéposition lente produit des surfaces lisses. Les "boîtes de conserve" sont en acier recouvert d'étain par électrolyse. Parfois, ces canettes sont chromées en une fraction de seconde avec l'épaisseur de la couche de chrome extrêmement mince.
Les références
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE.
- eMedical Prep. (2018). Applications de l'électrolyse. Récupéré de: emedicalprep.com
- Wikipédia. (2018). Cellule électrolytique. Récupéré de: en.wikipedia.org
- Professeur Shapley P. (2012). Cellules galvaniques et électrolytiques. Récupéré de: butane.chem.uiuc.edu
- Web de recherche Bodner. (s.f.). Cellules électrolytiques. Récupéré de: chemed.chem.purdue.edu



Personne n'a encore commenté ce post.