
Mécanismes de corrosion galvanique, exemples, protection
La corrosion galvanique ou électrochimique C'est un processus par lequel un métal ou un alliage se dégrade plus rapidement par rapport à son oxydation conventionnelle. On peut dire qu'il s'agit d'une oxydation accélérée, voire intentionnellement propice; comme cela se passe dans les cellules ou les batteries.
Cela se déroule sous un certain nombre de conditions. Tout d'abord, il doit y avoir un métal actif, appelé anode. En outre, et deuxièmement, il doit y avoir un métal noble faiblement réactif appelé cathode. Les troisième et quatrième conditions sont la présence d'un milieu dans lequel les électrons se propagent, comme l'eau, et des espèces ioniques ou des électrolytes..

La corrosion galvanique est observable notamment en milieu marin ou sur les rives des plages. Les courants d'air soulèvent des masses de vapeur d'eau, qui à leur tour transportent des ions; ces derniers finissent par adhérer à une fine couche d'eau ou à des gouttes qui reposent sur la surface métallique.
Ces conditions d'humidité et de salinité favorisent la corrosion du métal. Autrement dit, une couronne de fer comme celle de l'image ci-dessus rouillera plus rapidement si elle est exposée au voisinage de la mer..
La facilité qu'un métal aura à s'oxyder par rapport à un autre peut être mesurée quantitativement à travers ses potentiels de réduction; les livres de chimie regorgent de tableaux avec ces potentiels E. Plus il est négatif, plus il a tendance à rouiller.
De même, si ce métal est en présence d'un autre à potentiel de réduction très positif, présentant ainsi un ΔE important, l'oxydation du métal réactif sera plus agressive. D'autres facteurs, tels que le pH, la force ionique, l'humidité, la présence d'oxygène et la relation entre les zones du métal oxydé et réduit, sont également importants..
Index des articles
- 1 Mécanismes
- 1.1 Concepts et réactions
- 1.2 Dépolariseurs
- 1.3 Corrosion du fer
- 2 exemples
- 2.1 Indices anodiques
- 3 Protection contre la corrosion électrochimique
- 3.1 Revêtements sacrificiels
- 3.2 Revêtements nobles
- 4 Expérience pour les enfants
- 4.1 Plaque de fer en solution de sels de cuivre
- 4.2 Nettoyage de l'oxyde d'argent
- 5 Références
Mécanismes
Concepts et réactions
Avant d'aborder les mécanismes de la corrosion galvanique, certains concepts doivent être clarifiés.
Dans une réaction redox, une espèce perd des électrons (s'oxyde) tandis qu'une autre les gagne (réduit). L'électrode sur laquelle se produit l'oxydation s'appelle l'anode; et sur laquelle se produit la réduction, cathode (en anglais la règle mnémotechnique chat rouge se souvenir).
Ainsi, pour une électrode (pièce, vis, etc.) d'un métal M, si elle s'oxyde, on dit qu'il s'agit de l'anode:
M => Mn+ + ne-
Le nombre d'électrons libérés sera égal à l'amplitude de la charge positive du cation Mn+ résultant.
Puis une autre électrode ou métal R (les deux métaux doivent être en contact d'une manière ou d'une autre), reçoit les électrons libérés; mais celui-ci ne subit pas de réaction chimique s'il gagne des électrons, car il ne ferait que les conduire (courant électrique).
Par conséquent, il doit y avoir une autre espèce en solution qui peut formellement accepter ces électrons; sous forme d'ions métalliques facilement réduites, par exemple:
Rn+ + ne- => R
Autrement dit, une couche de métal R se formerait et l'électrode deviendrait donc plus lourde; tandis que le métal M perdrait de la masse en raison de la dissolution de ses atomes.
Dépolarisants
Et s'il n'y avait pas de cations métalliques qui pourraient être réduits assez facilement? Dans ce cas, d'autres espèces présentes dans le milieu prendront les électrons: les dépolariseurs. Ceux-ci sont étroitement liés au pH: Odeux, H+, Oh- et HdeuxOU ALORS.
L'oxygène et l'eau gagnent des électrons dans une réaction exprimée par l'équation chimique suivante:
OU ALORSdeux + 2HdeuxO + 4e- => 4OH-
Alors que les ions H+ transformer en Hdeux:
2H+ + 2e- => Hdeux
Autrement dit, l'espèce OH- et Hdeux sont des produits courants de corrosion galvanique ou électrochimique.
Même si le métal R ne participe à aucune réaction, le fait qu'il soit plus noble que M favorise son oxydation; et par conséquent, il y aura une production plus élevée d'ions OH- ou de l'hydrogène gazeux. Car, après tout, c'est la différence entre les potentiels de réduction, ΔE, l'un des principaux moteurs de ces processus.
Corrosion du fer
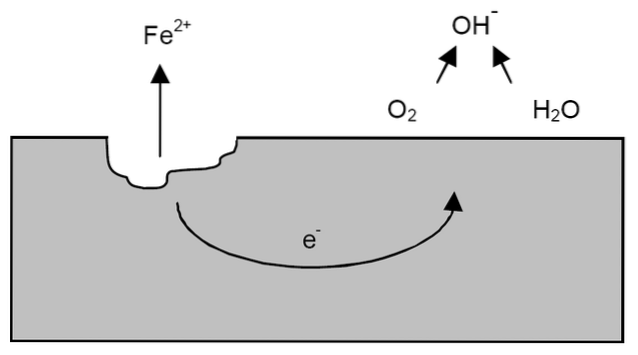
Après les précisions précédentes, l'exemple de la corrosion du fer peut être abordé (image du haut). Supposons qu'il y ait une fine couche d'eau dans laquelle l'oxygène se dissout. Sans la présence d'autres métaux, ce seront les dépolarisants qui fixeront les lignes directrices de la réaction.
Ainsi, le fer perdra certains atomes de sa surface pour se dissoudre dans l'eau sous forme de cations Fe.deux+:
Foi => Foideux+ + 2e-
Les deux électrons voyageront à travers le morceau de fer car c'est un bon conducteur d'électricité. Ainsi, où l'oxydation ou le site anodique a commencé est connu; mais pas l'endroit où la réduction se déroulera ni l'emplacement du site cathodique. Le site de la cathode peut être n'importe où; et plus sa surface possible est grande, plus le métal se corrode.
Supposons que les électrons atteignent un point comme indiqué dans l'image ci-dessus. Là, l'oxygène et l'eau subissent la réaction déjà décrite, par laquelle l'OH est libéré-. Ces anions OH- peut réagir avec le Fedeux+ pour former Fe (OH)deux, qui précipite et subit des oxydations ultérieures qui le transforment finalement en rouille.
Pendant ce temps, le site de l'anode se fissure de plus en plus.
Exemples
Dans la vie de tous les jours, les exemples de corrosion galvanique sont nombreux. Il n'est pas nécessaire de se référer à la couronne de fer: tout artefact en métal peut subir le même processus en présence d'environnements humides et salés.
En plus de la plage, l'hiver peut également offrir des conditions idéales pour la corrosion; par exemple, lors du pelletage de sels dans la neige sur la route pour empêcher les voitures de déraper.
Du point de vue physique, l'humidité peut être retenue dans les joints soudés de deux métaux, étant des sites actifs de corrosion. En effet, les deux métaux se comportent comme deux électrodes et la plus réactive perdra ses électrons..
Si la production d'ions OH- C'est considérable, cela peut même corroder la peinture de la voiture ou de l'appareil en question.
Indices anodiques
On peut construire ses propres exemples de corrosion galvanique en utilisant les tables de potentiel de réduction. Cependant, la table d'index anodique (simplifiée en elle-même) sera choisie pour illustrer ce point..
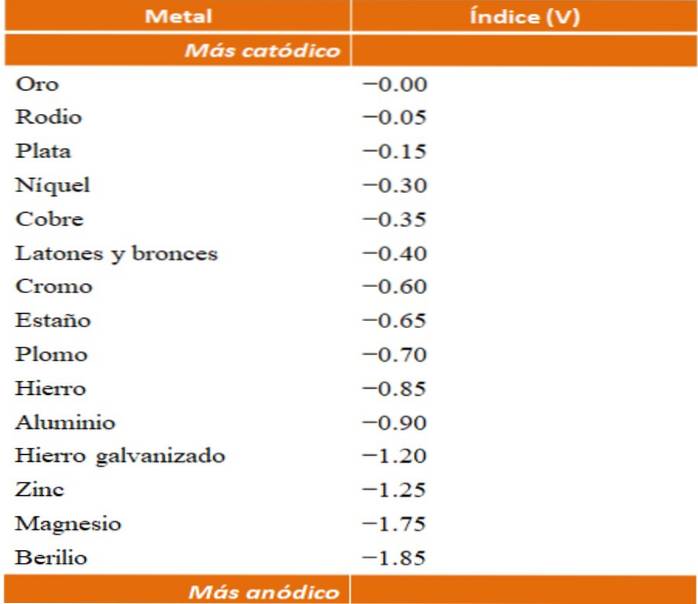
Supposons par exemple que nous voulions construire une cellule électrochimique. Les métaux qui sont en haut de la table d'index anodique sont plus cathodiques; c'est-à-dire qu'ils sont facilement réduits et qu'il sera donc difficile de les mettre en solution. Alors que les métaux qui sont au fond sont plus anodiques ou réactifs, et ils se corrodent facilement.
Si nous choisissons l'or et le béryllium, les deux métaux ne pourraient pas être ensemble longtemps, car le béryllium s'oxyderait extrêmement rapidement..
Et si, par contre, nous avons une solution d'ions Ag+ et nous y plongons une barre d'aluminium, celle-ci se dissoudra en même temps que les particules métalliques d'argent précipiteront. Si cette barre était connectée à une électrode en graphite, les électrons s'y rendraient pour y déposer électrochimiquement de l'argent sous forme de film d'argent..
Et si au lieu de la barre d'aluminium, elle était en cuivre, la solution deviendrait bleuâtre en raison de la présence d'ions Cu.deux+ dans l'eau.
Protection contre la corrosion électrochimique
Revêtements sacrificiels
Supposons que vous souhaitiez protéger une feuille de zinc de la corrosion en présence d'autres métaux. L'option la plus simple serait d'ajouter du magnésium, qui recouvrirait le zinc de sorte qu'une fois oxydés, les électrons libérés du magnésium réduiraient les cations Zn.deux+ de retour.
Cependant, le film de MgO sur zinc finirait par se fissurer le plus tôt possible, fournissant des sites d'anode à haute densité de courant; c'est-à-dire que la corrosion du zinc s'accélérerait brusquement en ces points.
Cette technique de protection électrochimique contre la corrosion est connue sous le nom d'utilisation de revêtements sacrificiels. Le plus connu est le zinc, utilisé dans la célèbre technique appelée galvanisation. En eux, le métal M, en particulier le fer, est recouvert de zinc (Fe / Zn).
Encore une fois, le zinc s'oxyde et son oxyde sert à recouvrir le fer et à lui transmettre des électrons qui réduisent le Fedeux+ qui peut être formé.
Revêtements nobles
Supposons à nouveau que vous vouliez protéger la même feuille de zinc, mais maintenant vous utiliserez du chrome au lieu du magnésium. Le chrome est plus noble (plus cathodique, voir tableau des indices anodiques) que le zinc, et fonctionne donc comme un revêtement noble.
Le problème avec ce type de revêtement est qu'une fois qu'il se fissure, il va encore favoriser et accélérer l'oxydation du métal en dessous; dans ce cas, le zinc se corrode encore plus que d'être recouvert de magnésium.
Et enfin, il existe d'autres revêtements constitués de peintures, de plastiques, d'antioxydants, de graisses, de résines, etc..
Expérience pour les enfants
Plaque de fer en dissolution de sels de cuivre
Une expérience simple peut être conçue à partir du même tableau d'indices d'anode. Dissoudre une quantité raisonnable (moins de 10 grammes) de CuSO45HdeuxOu dans l'eau, on demande à un enfant de plonger dans une assiette en fer poli. Une photo est prise et le processus est autorisé à se dérouler pendant quelques semaines.
La solution est initialement bleuâtre, mais commencera à s'estomper tandis que la plaque de fer prend une couleur cuivrée. En effet, le cuivre est plus noble que le fer, et donc ses cations Cudeux+ Ils seront réduits en cuivre métallique à partir des ions donnés par l'oxydation du fer:
Foi => Foideux+ + 2e-
Cudeux+ + 2e- => Cu
Nettoyage à l'oxyde d'argent
Les objets en argent noircissent avec le temps, surtout s'ils sont en contact avec une source de composés soufrés. Sa rouille peut être éliminée en immergeant l'objet dans une cuve d'eau avec du bicarbonate de soude et du papier d'aluminium. Le bicarbonate fournit les électrolytes qui faciliteront le transport des électrons entre l'objet et l'aluminium.
En conséquence, l'enfant appréciera que l'objet perd ses points noirs et brillera de sa couleur argentée caractéristique; tandis que la feuille d'aluminium se corrode pour disparaître.
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2019). Corrosion galvanique. Récupéré de: en.wikipedia.org
- Stephen Lower. (16 juin 2019). Corrosion électrochimique. Chimie LibreTexts. Récupéré de: chem.libretexts.org
- L'Université ouverte. (2018). 2.4 Processus de corrosion: corrosion galvanique. Récupéré de: open.edu
- Service technique à la clientèle Brush Wellman Inc. (s.f.). Un guide sur la corrosion galvanique. Brosse Wellman Engineered Materials.
- Giorgio Carboni. (1998). Expériences en électrochimie. Récupéré de: funsci.com



Personne n'a encore commenté ce post.