
Propriétés du bichromate de sodium (Na2Cr2O7), production, utilisations

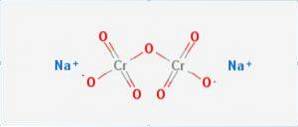
le bichromate de sodium c'est un composé inorganique de formule Na2Cr2O7. C'est l'un des nombreux composés du chrome hexavalent (Cr VI). Sa structure est illustrée sur la figure 1, bien que le sel soit généralement manipulé sous sa forme dihydratée, dont la formule serait Na2Cr2O7 · H2O.
Il a deux liaisons ioniques entre les molécules de sodium et l'oxygène chargé négativement. Le minerai de chrome est extrait du dichromate de sodium. Des millions de kilogrammes de dichromate de sodium sont produits chaque année.
La Chine est le plus grand producteur de bichromate de sodium, mais les usines chimiques chinoises ont une production relativement faible, moins de 50 000 tonnes par an chacune, par rapport à l'usine kazakhe qui en produit plus de 100 000 tonnes par an..
Les usines en Russie, aux États-Unis et au Royaume-Uni ont une production intermédiaire entre 50 000 et 100 000 tonnes par an (Kogel, 2006).
En termes de réactivité et d'aspect, le bichromate de sodium a des propriétés similaires au bichromate de potassium, cependant, le sel de sodium est plus soluble dans l'eau et a un poids équivalent inférieur au sel de potassium..
Le dichromate de sodium produit des fumées toxiques de chrome lorsqu'il est chauffé. C'est un agent oxydant puissant et très corrosif.
Ce composé peut être trouvé dans les sources d'eau potable contaminées provenant de différents procédés industriels tels que les techniques de galvanisation ou de galvanoplastie, le tannage du cuir et la fabrication de textiles..
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Méthodes de production
- 3 Réactivité et dangers
- 4 Utilisations et applications
- 5 Biochimie
- 6 Références
Proprietes physiques et chimiques
Le bichromate de sodium est composé de cristaux à structure monoclinique de couleur rouge-orange sous leur forme anhydre et inodore. Son poids moléculaire est de 261,97 g / mol sous sa forme anhydre et de 298,00 g / mol sous sa forme dihydratée..
Il a un point de fusion de 356,7 degrés Celsius, un point d'ébullition de 400 degrés Celsius auquel il se décompose. Il a une densité de 2,52 g / ml.

L'apparence du bichromate de sodium est illustrée à la figure 2. Sa solubilité dans l'eau est de 187 g pour 100 grammes à 25 degrés Celsius et sa solubilité dans l'éthanol est de 513,2 grammes par litre à 19,4 degrés Celsius (National Center for Biotechnology Information, s.d.).
Il est considéré comme un composé stable s'il est stocké dans les conditions recommandées et qu'il n'est pas inflammable. Puisqu'il s'agit d'un agent oxydant fort, il est corrosif et, en solution, il s'agit d'un acide ayant la capacité d'abaisser le pH à 4 dans une solution à 1% p / v..
Méthodes de production
Le chromate de sodium peut être converti en bichromate grâce à un processus continu qui traite de l'acide sulfurique, du dioxyde de carbone ou d'une combinaison des deux..
L'évaporation de la liqueur de bichromate de sodium provoque la précipitation du sulfate de sodium et / ou du bicarbonate de sodium, et ces composés sont éliminés avant la cristallisation finale du bichromate de sodium..
Le dichromate de sodium peut être fabriqué en trois étapes:
- Conditions d'oxydation du chromite grillé alcalin
- Lixiviation. Extraction de matière soluble d'un mélange par action d'un solvant liquide
- Conversion du monochromate de sodium en bichromate de sodium au moyen d'un acide.
Le bichromate de sodium anhydre peut être préparé en faisant fondre du dichromate de sodium dihydraté, en cristallisant des solutions aqueuses de bichromate au-dessus de 86 degrés C, ou en séchant des solutions de bichromate de sodium dans des sécheurs par atomisation..
Les solutions de bichromate de sodium à 69 et 70% p / v sont utilisées comme une méthode pratique et rentable pour expédier des quantités, évitant le besoin de manipulation manuelle ou de dissolution des cristaux..
Réactivité et dangers
C'est un agent oxydant puissant. Incompatible avec les acides forts. Le contact avec des matériaux combustibles peut provoquer des incendies. Des vapeurs toxiques d'oxyde de chrome peuvent se former en présence de chaleur ou d'incendie.
Le "mélange d'acide chromique" bien connu de bichromate et d'acide sulfurique avec des résidus organiques donne lieu à une violente réaction exothermique. Ce mélange en combinaison avec des résidus d'acétone conduit également à une réaction violente..
L'association du bichromate et de l'acide sulfurique avec des alcools, de l'éthanol et du 2-propanol, donne lieu à une violente réaction exothermique. En raison de la survenue de nombreux incidents impliquant le mélange d'acide dichromate-sulfurique avec des matières organiques oxydables, il est probablement préférable d'éviter de telles interactions..
La combinaison du bichromate et de l'hydrazine est explosive, la réaction du bichromate peut être attendue vigoureuse avec les amines en général. L'addition du sel de bichromate déshydraté à l'anhydride acétique conduit à une réaction exothermique finalement explosive..
Le bore, le silicium et les bichromates forment des mélanges pyrotechniques. Un mélange d'acide acétique, de 2-méthyl-2-penténal et de bichromate conduit à une réaction rampante (Fiche technique chimique Sodium Dichromate., 2016).
L'inhalation de poussière ou de brouillard provoque une irritation respiratoire qui ressemble parfois à de l'asthme. Une perforation septale peut survenir. C'est considéré comme un poison.
L'ingestion provoque des vomissements, de la diarrhée et, de façon très inhabituelle, des complications gastriques et rénales. Le contact avec les yeux ou la peau provoque une irritation locale. Une exposition cutanée répétée provoque une dermatite.
Le bichromate de sodium est cancérogène pour l'homme. Il est prouvé que le chrome hexavalent ou les composés Cr (VI) peuvent provoquer le cancer du poumon chez l'homme. Il a été démontré que le dichromate de sodium provoque le cancer du poumon chez les animaux.
Bien que le dichromate de sodium n'ait pas été identifié comme un composé à risque tératogène ou reproductif, il est connu que le chrome hexavalent ou les composés Cr (VI) sont tératogènes et causent des troubles de la reproduction tels que la réduction de la fertilité et l'interférence avec les cycles menstruels..
Le bichromate de sodium peut causer des dommages au foie et aux reins, il doit donc être manipulé avec un soin extrême (New Jersey Department of Health, 2009).
En cas d'ingestion, la victime doit boire de l'eau ou du lait; ne jamais faire vomir. En cas de contact avec la peau ou les yeux, il doit être traité comme des brûlures acides; se rincer les yeux à l'eau pendant au moins 15 minutes.
Les lésions externes peuvent être frottées avec une solution de thiosulfate de sodium à 2%. Dans tous les cas, un médecin doit être consulté.
Utilisations et applications
Outre son importance dans la fabrication d'autres produits chimiques à base de chrome, le bichromate de sodium a également de nombreuses utilisations directes en tant qu'ingrédient dans la production de:
- Finition métallique: aide à la résistance à la corrosion et nettoie les surfaces métalliques, favorise également l'adhérence de la peinture.
- Produits biologiques: utilisés comme agents oxydants dans la fabrication de produits tels que la vitamine K et la cire.
- Pigments: utilisé dans la fabrication de pigments de chromate inorganique où il produit une gamme de couleurs stables à la lumière. Certaines qualités de chromate sont également utilisées comme inhibiteurs de corrosion dans les sous-couches et les apprêts..
- Céramique: utilisée dans la préparation de vitrages colorés et de glaçures céramiques.
- Textile: utilisé comme mordant pour les colorants acides pour améliorer leurs propriétés de coloration rapide.
- Production de sulfate de chrome.
(Dichromate de sodium. La pierre angulaire de pratiquement tous les autres composés du chrome., 2010-2012)
Dihydrate de dichromate de sodium, idéal pour une utilisation dans diverses conditions, y compris des applications à haute température telles que les glaçures céramiques et le verre coloré.
L'oxyde chromique, étant plus dur que les autres oxydes métalliques, tels que le titane ou le fer, est idéal pour les environnements où la température et les conditions de processus sont agressives.
Cette substance est principalement utilisée pour produire d'autres composés de chrome, mais elle est également utilisée dans les boues de bentonite utilisées dans la production de pétrole, dans les produits de préservation du bois, dans la production de produits chimiques organiques et comme inhibiteur de corrosion..
Lorsqu'il est mélangé avec du bichromate de potassium et d'aluminium, en utilisant le procédé thermique à l'aluminium, l'oxyde de chrome produit du chrome métallique de haute pureté. Il s'agit d'un ingrédient essentiel dans la production des superalliages hautes performances utilisés dans l'industrie aérospatiale..
En synthèse organique, le bichromate de sodium est utilisé comme agent oxydant dans les réactions de réduction des oxydes en présence d'acide sulfurique..
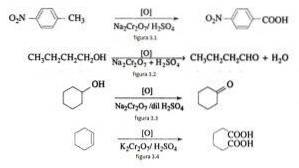
Par exemple, l'oxydation du p nitrotoluène pour former de l'acide p nitrobenzoïque, dans l'oxydation du n-butanol pour former du n-butaldéhyde, dans la formation de cyclohexanone à partir du cyclohexanol et la formation d'acide adipique comme illustré dans les figures 3.1, 3.2, 3.3 et 3.4 respectivement (VK Ahluwalia, 2004).
Biochimie
L'instillation intratrachéale de bichromate de sodium (CrVI) et d'hydroxyde d'acétate de chrome (CrIII) chez les rats mâles a entraîné une augmentation des concentrations de chrome dans le sang total, le plasma et l'urine jusqu'à 72 heures après l'exposition; Les concentrations maximales ont été atteintes 6 heures après l'exposition..
Le rapport entre les concentrations de chrome dans le sang total et de chrome plasmatique était significativement différent pour les traitements au Cr (VI) et au Cr (III). Par conséquent, des tests de chrome sanguin et de chrome plasmatique doivent être utilisés pour l'évaluation de l'exposition au chrome..
Du chrome a également été détecté dans les lymphocytes périphériques. Cr (VI), mais pas Cr (III), s'est accumulé de manière significative dans les lymphocytes après le traitement. Ces cellules ont le potentiel d'être utilisées comme biomarqueurs dans l'évaluation de l'exposition aux composés du chrome (Hooth, 2008).
Les références
- Fiche technique chimique Dichromate de sodium. (2016). Récupéré de produits chimiques camées: cameochemicals.noaa.
- Hooth, M. J. (2008). Rapport technique sur les études de toxicologie et de carcinogenèse du dichromate de sodium dihydraté. Institut national de la santé des États-Unis.
- Kogel, J. E. (2006). Minéraux industriels et roches: produits de base, marchés et utilisations, septième édition. littleton colorado: société des mines, de la métallurgie et de l'exploration inc.
- Centre national d'information sur la biotechnologie. (s.f.). Base de données des composés PubChem; CID = 25408. Récupéré de pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Département de la santé du New Jersey. (2009, novembre). fiche d'information sur les substances dangereuses bichromate de sodium. Récupéré de nj.gov: nj.gov.
- Dichromate de sodium. La pierre angulaire de pratiquement tous les autres composés de chrome. (2010-2012). Récupéré de elementis chrome: elementischromium.com
- K. Ahluwalia, R. A. (2004). Chimie organique pratique complète: préparations et analyses quantitatives. Delhi: Presse universitaire (Inde).



Personne n'a encore commenté ce post.