
Caractéristiques, structure et fonctions du domaine SH2
le Domaine SH2 (Homologie Src 2) est un domaine protéique hautement conservé en évolution et présent dans plus de 100 protéines différentes, la plus importante étant l'oncoprotéine src, impliquée dans le processus de transduction du signal au sein de la cellule.
La fonction du domaine est de se lier aux séquences de tyrosine phosphorylées sur les protéines cibles; Cette union déclenche une série de signaux qui régulent l'expression des gènes. Ce domaine a également été trouvé dans l'enzyme tyrosine phosphatase.
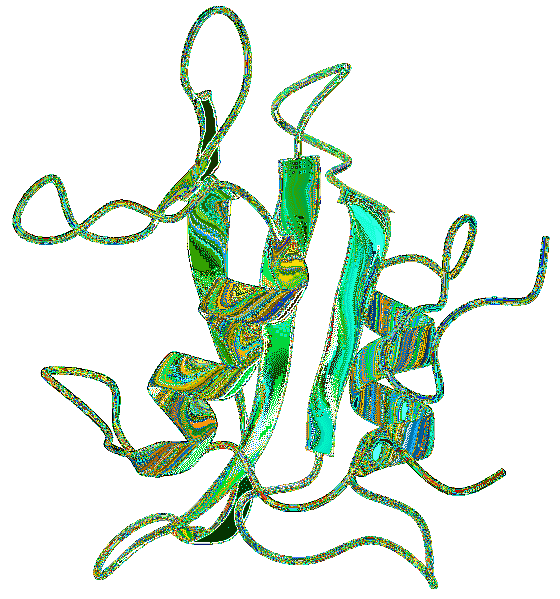
Les domaines SH2 sont généralement trouvés avec d'autres domaines qui ont été associés à des voies de transduction de signal. L'une des interactions les plus courantes est la connexion avec les domaines SH2 et SH3, qui semble être impliqué dans la régulation de l'interaction avec des séquences riches en proline..
Les protéines peuvent contenir un seul domaine SH2 ou plus d'un, comme la protéine GAP et la sous-unité p85 des phosphoinositol 3-kinases..
Le domaine SH2 a été largement étudié par l'industrie pharmaceutique afin de générer des médicaments pour lutter contre des maladies telles que le cancer, les allergies, les maladies auto-immunes, l'asthme, le sida, l'ostéoporose, entre autres..
Index des articles
- 1 Fonctionnalités
- 2 Structure
- 3 fonctions
- 4 Évolution
- 5 Implications cliniques
- 5.1 Lymphoprolifératif lié à l'X
- 5.2 Agammaglobulinémie liée à l'X
- 5.3 Syndrome de Noonan
- 6 Références
Caractéristiques
Le domaine SH2 se compose d'environ 100 acides aminés connectés à des domaines catalytiques. L'exemple le plus évident est celui des enzymes tyrosine kinase, qui sont responsables de la catalyse du transfert d'un groupe phosphate de l'ATP aux résidus d'acide aminé tyrosine..
En outre, des domaines SH2 ont été signalés dans des domaines non catalytiques tels que crk, grb2 / sem5 et nck..
Les domaines SH2 sont présents chez les eucaryotes supérieurs et il a été suggéré qu'ils apparaissent également dans la levure. En ce qui concerne les bactéries, dans Escherichia coli un module qui rappelle les domaines SH2 a été signalé.
La protéine src est la première tyrosine kinase découverte, qui lorsqu'elle est mutée est probablement impliquée dans la régulation de l'activité kinase et également dans la promotion des interactions de ces protéines avec d'autres composants au sein de la cellule.
Après la découverte des domaines dans la protéine scr, le domaine SH2 a été identifié dans un nombre significatif de protéines très variées, y compris les protéines tyrosine kinases et les facteurs de transcription..
Structure
La structure du domaine SH2 a été révélée par l'utilisation de techniques telles que la diffraction des rayons X, la cristallographie et la RMN (résonance magnétique nucléaire), trouvant des modèles communs dans la structure secondaire des domaines SH2 étudiés..
Le domaine SH2 a cinq motifs hautement conservés. Un domaine générique est composé de feuillets β de noyau avec de petites portions adjacentes de feuillets β antiparallèles, flanqués de deux hélices α..
Les résidus d'acides aminés sur un côté de la feuille et dans la région αA N-terminale sont impliqués dans la coordination de la liaison des peptides. Cependant, le reste des caractéristiques des protéines est assez variable parmi les domaines étudiés..
Dans la partie carbone terminale, un résidu isoleucine se trouve en troisième position et forme une poche hydrophobe à la surface du domaine SH2..
Une caractéristique importante est l'existence de deux régions, chacune ayant une fonction particulière. La zone entre la première hélice α et la feuille β est le site de reconnaissance de la phosphotyrosine.
De même, la région entre la feuille β et l'hélice α du carbone terminal forme une région responsable de l'interaction avec les résidus carbonés terminaux de la phosphotyrosine.
Caractéristiques
La fonction du domaine SH2 est la reconnaissance de l'état de phosphorylation au niveau des résidus d'acide aminé tyrosine. Ce phénomène est crucial dans la transduction du signal, lorsqu'une molécule située à l'extérieur de la cellule est reconnue par un récepteur sur la membrane et traitée à l'intérieur de la cellule..
La transduction du signal est un événement régulateur extrêmement important, dans lequel la cellule répond aux changements de son environnement extracellulaire. Ce processus se produit grâce à la transduction de signaux externes contenus dans certains messagers moléculaires à travers sa membrane..
La phosphorylation de la tyrosine conduit à l'activation séquentielle des interactions protéine-protéine, ce qui entraîne une modification de l'expression génique ou une modification de la réponse cellulaire.
Les protéines contenant des domaines SH2 sont impliquées dans les voies de régulation liées aux processus cellulaires essentiels, tels que le réarrangement du cytosquelette, l'homéostasie, les réponses immunitaires et le développement..
Évolution
La présence du domaine SH2 a été rapportée dans l'organisme unicellulaire primitif Monosiga brevicollis. On pense que ce domaine a évolué en tant qu'unité de signalisation invariante avec l'apparition de la phosphorylation de la tyrosine..
On suppose que la disposition ancestrale du domaine a servi à diriger les kinases vers leurs substrats. Ainsi, avec l'augmentation de la complexité des organismes, les domaines SH2 ont acquis de nouvelles fonctions au cours de l'évolution, comme la régulation allostérique du domaine catalytique des kinases..
Implications cliniques
Lymphoprolifératif lié à l'X
Certains domaines SH2 mutés ont été identifiés comme causant des maladies. Les mutations dans le domaine SH2 dans SAP provoquent une maladie lymphoproliférative liée à l'X, qui provoque une forte augmentation de la sensibilité à certains virus et donc une prolifération incontrôlée des cellules B..
La prolifération se produit parce que la mutation des domaines SH2 provoque des échecs dans les voies de signalisation entre les cellules B et T, conduisant à des infections virales et à une croissance incontrôlée des cellules B. Cette maladie a un taux de mortalité élevé.
Agammaglobulinémie liée à l'X
De même, les mutations de strut dans le domaine SH2 de la protéine kinase de Bruton sont responsables d'une condition appelée agammaglobulinémie..
Cette condition est liée à l'X, caractérisée par un manque de cellules B et une diminution marquée des niveaux d'immunoglobulines..
Syndrome de Noonan
Enfin, des mutations dans la région N-terminale du domaine SH2 de la protéine tyrosine phosphatase 2 sont à l'origine du syndrome de Noonan..
Cette pathologie est principalement caractérisée par des maladies cardiaques, une petite taille due à une croissance plus lente et des anomalies faciales et squelettiques. De plus, la condition peut présenter un retard mental et psychomoteur dans un quart des cas étudiés..
Les références
- Berg, J. M., Stryer, L. et Tymoczko, J. L. (2007). Biochimie. Renversé.
- Filippakopoulos, P., Müller, S., et Knapp, S. (2009). Domaines SH2: modulateurs de l'activité tyrosine kinase non réceptrice. Opinion actuelle en biologie structurale, 19(6), 643-649.
- Kurochkina, N. (éd.). (2015). Domaines Sh: structure, mécanismes et applications. Springer.
- Sawyer, T. K. (1998). Homologie SRC - 2 domaines: structure, mécanismes et découverte de médicaments. Science des peptides, 47(3), 243-261.
- Schlessinger, J. (1994). Protéines de signalisation SH2 / SH3. Opinion actuelle en génétique et développement, 4(1), 25-30.



Personne n'a encore commenté ce post.