
Propriétés, risques et utilisations de l'acide perbromique (HBrO4)

le acide perbromique ou l'acide tétraoxo bromique est un composé inorganique de formule HBrO4. Sa structure est présentée dans la figure 1 (EMBL-EBI, 2007). C'est un acide de brome oxacide, où il a un état d'oxydation 7+.
Il est instable et ne peut pas être formé par déplacement du chlore de l'acide perchlorique lorsque l'acide perbromique est préparé; ne peut se faire que par protonation de l'ion perbromate.
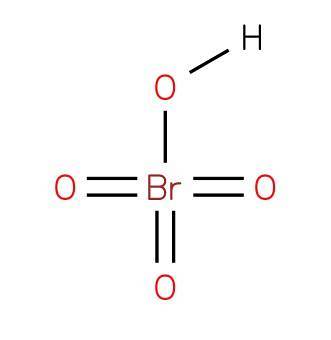
L'acide perbromique est un acide fort et un puissant agent oxydant. C'est le moins stable des oxydes halogènes (VII). Se décompose rapidement en acide bromique et en oxygène, libérant des fumées de brome brun toxiques.
Sa base conjuguée est l'ion perbromate qui, contrairement aux perchlorates, n'est pas accessible par électrolyse. Il se forme en faisant réagir des bromates avec de l'ozone ou lorsque l'acide perbromique réagit avec des bases (Ropp, 2013). Une nouvelle synthèse de perbromates a été développée, qui consiste en l'oxydation du bromate avec du fluor en solution alcaline.
Copain3- + Fdeux + HdeuxO → BrO4- + HF
Il a été découvert par la désintégration d'un échantillon de sélénate radioactif (SeO4-). Le composé est également produit en exposant des cristaux de bromate à un rayonnement γ (A. J. Downs, 1973)
L'acide perbromique est un acide monobasique fort. Ses solutions aqueuses sont stables jusqu'à environ 6 M (55% HBrO4) mais se décomposent à des concentrations plus élevées (Appelman, 1969).
Index des articles
- 1 Propriétés physiques et chimiques
- 2 Réactivité et dangers
- 3 utilisations
- 4 Références
Proprietes physiques et chimiques
L'acide perbromique n'existe qu'en solution. C'est un liquide incolore sans arôme caractéristique (National Center for Biotechnology Information, 2017).
Le composé a un poids moléculaire de 144,908 g / mol. Compte tenu de son instabilité, ses propriétés ont été calculées par des méthodes de calcul, obtenant ainsi un point de fusion et d'ébullition de 204,77 ° C et 512,23 ° C respectivement..
Sa solubilité dans l'eau, également obtenue par des calculs informatiques, est de l'ordre de 1 x 106 mg par litre à 25 ° C (Royal Society of Chemistry, 2015). L'acide perbromique est un acide fort, n'ayant qu'un seul proton pour chaque atome de brome heptavalent. En solution aqueuse, l'ion hydronium et le BrO sont complètement dissociés4-.
Les solutions avec des concentrations supérieures à 6M (55% p / v) sont instables dans l'air, une décomposition autocatalytique du composé se produit, qui est complète à des concentrations de 80%. Cette réaction de décomposition est également catalysée par des métaux tels que Ce4+ et Ag+ (Egon Wiberg, 2001).
Réactivité et dangers
L'acide perbromique est un composé instable, mais il a des propriétés d'acide fort lorsqu'il est isolé. Il est extrêmement dangereux en cas de contact avec la peau (il est corrosif et irritant), en contact avec les yeux (irritant) et en cas d'ingestion. Également très dangereux en cas d'inhalation.
Une surexposition sévère peut provoquer des lésions pulmonaires, une suffocation, une perte de conscience ou la mort. Une exposition prolongée peut provoquer des brûlures et des ulcérations cutanées. Une surexposition par inhalation peut provoquer une irritation respiratoire..
L'inflammation de l'œil se caractérise par une rougeur, un larmoiement et des démangeaisons. L'inflammation de la peau est caractérisée par des démangeaisons, une desquamation, des rougeurs et parfois des cloques.
La substance est toxique pour les reins, les poumons et les muqueuses. Une exposition répétée ou prolongée à la substance peut provoquer des lésions de ces organes..
En cas de contact avec les yeux, vérifiez si vous portez des lentilles de contact et retirez-les immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. De l'eau froide peut être utilisée. La pommade oculaire ne doit pas être utilisée.
Si le produit chimique entre en contact avec les vêtements, retirez-le le plus rapidement possible, en protégeant vos mains et votre corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule sur la peau exposée de la victime, comme les mains, la peau contaminée est lavée doucement et soigneusement à l'eau courante et au savon non abrasif..
L'acide peut également être neutralisé avec de l'hydroxyde de sodium dilué ou une base faible telle que le bicarbonate de soude. Si l'irritation persiste, consulter un médecin. Lavez les vêtements contaminés avant de les réutiliser.
Si le contact avec la peau est sévère, elle doit être lavée avec un savon désinfectant et recouvrir la peau contaminée d'une crème antibactérienne..
En cas d'inhalation, la victime doit être autorisée à se reposer dans un endroit bien ventilé. Si l'inhalation est sévère, la victime doit être évacuée vers une zone sûre dès que possible..
Desserrez les vêtements serrés comme un col de chemise, une ceinture ou une cravate. Si la victime a du mal à respirer, de l'oxygène doit être administré. Si la victime ne respire pas, une réanimation bouche-à-bouche est effectuée.
Toujours en tenant compte du fait qu'il peut être dangereux pour la personne qui fournit de l'aide de faire une réanimation bouche-à-bouche, lorsque le matériel inhalé est toxique, infectieux ou corrosif.
En cas d'ingestion, ne pas faire vomir. Desserrez les vêtements serrés tels que les cols de chemises, les ceintures ou les cravates. Si la victime ne respire pas, effectuez une réanimation bouche-à-bouche. Dans tous les cas, consultez immédiatement un médecin..
Applications
L'acide perbromique est principalement utilisé comme agent réducteur en laboratoire. Les solutions d'acide perbromique dilué sont des agents oxydants lents malgré leur grand potentiel REDOX (+1,76 volts) mais c'est un meilleur oxydant que l'acide perchlorique.
L'acide perbromique peut oxyder lentement les ions bromure et iodure. Dans les solutions de concentration molaire 12, il peut rapidement oxyder l'ion chlorure et exploser en présence d'acide nitrique. Les solutions de 3 concentrations molaires d'acide perbromique peuvent facilement oxyder l'acier inoxydable.
A une température de 100 ° C, 6 solutions molaires d'acide perbromique peuvent oxyder l'ion manganèse (Mndeux+) au permanganate (MnO4-). La réduction du composé en brome peut être obtenue avec du chlorure d'étain (SnOdeux).
L'autre utilisation de l'acide perbromique est la synthèse de sels de perbromate tels que le perbromate de sodium ou le perbromate de potassium..
Ce dernier est un composé assez stable qui résiste à des températures de 274 ° C. À des températures plus élevées, il est réduit en bromate de potassium, contrairement au perchlorate qui, à des températures élevées, produit de l'oxygène et du chlorure de potassium.
Les références
- J. Downs, C. J. (1973). La chimie du chlore, du brome, de l'iode et de l'astatine. Oxford: Pergamon press LTD.
- Appelman, E. H. (1969). Acide perbromique et perbromates: synthèse et quelques propriétés. Chimie inorganique 8 (2) , 223-227. Récupéré de researchgate.net.
- Egon Wiberg, N. W. (2001). Chimie inorganique. New York: Presse académique.
- EMBL-EBI. (28 octobre 2007). acide perbromique. Récupéré de ebi.ac.uk.
- Centre national d'information sur la biotechnologie. (30 avril 2017). Base de données des composés PubChem; CID = 192513. Récupéré de pubchem.ncbi.nlm.nih.gov.
- Ropp, R. C. (2013). Encyclopédie des composés alcalino-terreux. Oxford: Elsevier.
- Société royale de chimie. (2015). Acide perbromique. Récupéré de chemspider.com.

Personne n'a encore commenté ce post.