
Concept et explication du principe d'Aufbau, exemples
le Principe d'Aufbau Il s'agit d'un guide utile pour prédire théoriquement la configuration électronique d'un élément. Mot aufbau fait référence au verbe allemand «construire». Les règles dictées par ce principe visent à "aider à construire l'atome".
Lorsqu'on parle de la construction atomique hypothétique, il se réfère exclusivement aux électrons, qui à leur tour vont de pair avec le nombre croissant de protons. Les protons définissent le numéro atomique Z d'un élément chimique, et pour chacun ajouté au noyau, un électron est ajouté pour compenser cette augmentation de charge positive..
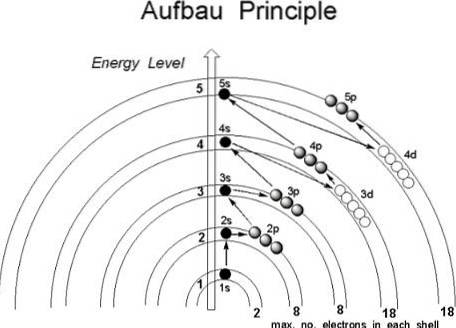
Bien qu'il semble que les protons ne suivent pas un ordre établi pour rejoindre le noyau de l'atome, les électrons suivent une série de conditions, de telle sorte qu'ils occupent d'abord les régions de l'atome à plus faible énergie, en particulier celles où le la probabilité de les trouver dans l'espace est plus grande: les orbitales.
Le principe Aufbau, avec d'autres règles de remplissage électronique (le principe d'exclusion de Pauli et la règle de Hund), aide à établir l'ordre dans lequel les électrons doivent être ajoutés au nuage d'électrons; de cette manière, il est possible d'attribuer une configuration électronique appropriée à un certain élément chimique.
Index des articles
- 1 Concept et explication
- 1.1 Couches et sous-couches
- 1.2 Principe d'exclusion de Pauli et règle de Hund
- 2 exemples
- 2.1 Carbone
- 2.2 Oxygène
- 2.3 Calcium
- 3 Limitations du principe Aufbau
- 4 Références
Concept et explication
Si l'atome était considéré comme un oignon, on y trouverait un nombre fini de couches, déterminé par le nombre quantique principal n.
De plus, à l'intérieur d'eux, se trouvent les sous-couches, dont les formes dépendent des nombres quantiques azimutal l et magnétique m.
Les orbitales sont identifiées par les trois premiers nombres quantiques, tandis que le quatrième, le spin s, finit par indiquer dans quelle orbitale l'électron sera situé. C'est alors dans ces régions de l'atome que tournent les électrons, des couches les plus internes aux couches externes: la couche de valence, la plus énergétique de toutes..
Ceci étant le cas, dans quel ordre les électrons doivent-ils remplir les orbitales? Selon le principe Aufbau, ils doivent être attribués en fonction de la valeur croissante (n + l).
De même, à l'intérieur des sous-couches (n + l), les électrons doivent occuper la sous-couche avec la valeur d'énergie la plus faible; en d'autres termes, ils occupent la valeur la plus basse de n.
En suivant ces règles de construction, Madelung a développé une méthode visuelle qui consiste à dessiner des flèches diagonales, qui aident à construire la configuration électronique d'un atome. Dans certaines sphères éducatives, cette méthode est également connue sous le nom de méthode de la pluie..
Couches et sous-couches
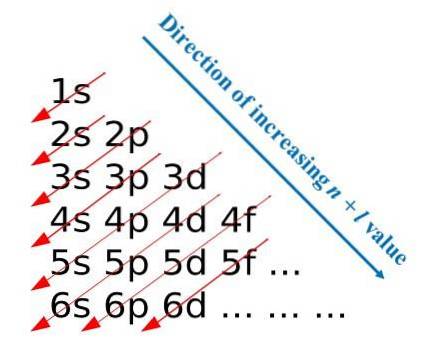
La première image illustre une méthode graphique pour obtenir les configurations électroniques, tandis que la seconde image est la méthode de Madelung respective. Les couches les plus énergétiques sont situées au sommet et les moins énergétiques sont orientées vers le bas..
De gauche à droite, les sous-couches s, p, d et f de leurs principaux niveaux d'énergie correspondants sont «transitées». Comment calculer la valeur de (n + l) pour chaque pas marqué par les flèches diagonales? Par exemple, pour l'orbite 1s, ce calcul est égal à (1 + 0 = 1), pour l'orbite 2s (2 + 0 = 2) et pour l'orbite 3p (3 + 1 = 4).
Le résultat de ces calculs est à l'origine de la construction de l'image. Par conséquent, s'il n'est pas disponible à portée de main, déterminez simplement (n + l) pour chaque orbitale, en commençant à remplir les orbitales d'électrons de celui avec la valeur la plus basse de (n + l) à celui avec la valeur maximale.
Cependant, l'utilisation de la méthode Madelung facilite grandement la construction de la configuration électronique et en fait une activité divertissante pour ceux qui apprennent le tableau périodique..
Principe d'exclusion de Pauli et règle de Hund
La méthode Madelung n'indique pas les orbitales des sous-couches. En les prenant en compte, le principe d'exclusion de Pauli stipule qu'aucun électron ne peut avoir les mêmes nombres quantiques qu'un autre; ou ce qui est pareil, une paire d'électrons ne peut pas avoir à la fois des spins positifs ou négatifs.
Cela signifie que leurs nombres quantiques de spin s ne peuvent pas être égaux et, par conséquent, leurs spins doivent se coupler lorsqu'ils occupent la même orbitale..
Par contre, le remplissage des orbitales doit se faire de manière à ce qu'elles dégénèrent en énergie (règle de Hund). Ceci est réalisé en gardant tous les électrons dans les orbitales non appariés, jusqu'à ce qu'il soit strictement nécessaire d'apparier une paire de ceux-ci (comme avec l'oxygène).
Exemples
Les exemples suivants résument tout le concept du principe Aufbau..
Carbone
Pour déterminer sa configuration électronique, il faut d'abord connaître le numéro atomique Z, et donc le nombre d'électrons. Le carbone a Z = 6, donc ses 6 électrons doivent être situés dans les orbitales en utilisant la méthode de Madelung:

Les flèches correspondent aux électrons. Après avoir rempli les orbitales 1 et 2, chacune avec deux électrons, les orbitales 2p par différence se voient attribuer les deux électrons restants. La règle de Hund se manifeste ainsi: deux orbitales dégénérées et une vide.
Oxygène

L'oxygène a Z = 8, donc il a deux électrons supplémentaires contrairement au carbone. L'un de ces électrons doit être placé dans l'orbitale vide 2p, et l'autre doit se coupler pour former la première paire, avec la flèche pointant vers le bas. Par conséquent, ici se manifeste le principe d'exclusion de Pauli.
Calcium
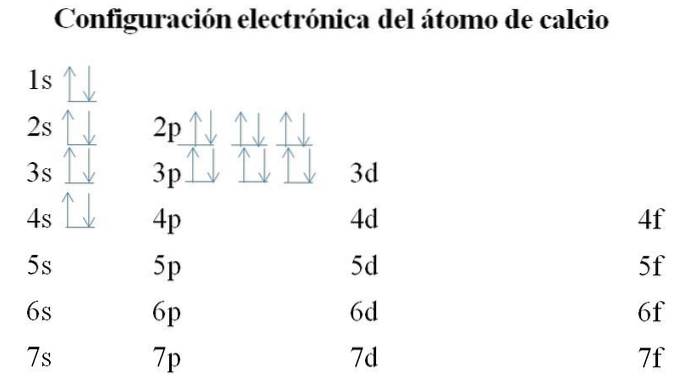
Le calcium a 20 électrons et les orbitales sont toujours remplies de la même méthode. L'ordre de remplissage est le suivant: 1s-2s-2p-3s-3p-4s.
On peut noter qu'au lieu de remplir l'orbitale 3d en premier, les électrons occupent les 4s. Cela se produit avant de laisser la place aux métaux de transition, éléments qui remplissent la couche interne 3d.
Limitations du principe Aufbau
Le principe d'Aufbau ne permet pas de prédire les configurations électroniques de nombreux métaux de transition et éléments de terres rares (lanthanides et actinides).
En effet, les différences énergétiques entre les orbitales ns et (n-1) d sont faibles. Pour des raisons soutenues par la mécanique quantique, les électrons peuvent préférer dégénérer les orbitales (n-1) d au prix de défaire ou de déloger les électrons de l'orbitale ns..
Un exemple célèbre est le cas du cuivre. Sa configuration électronique prédite par le principe d'Aufbau est de 1sdeux2 sdeux2 P63 sdeux3p64 sdeux3d9, quand il a été démontré expérimentalement qu'il était 1sdeux2 sdeux2 P63 sdeux3p64 s13ddix.
Dans le premier, un électron solitaire n'est pas apparié dans une orbitale 3d, tandis que dans le second, tous les électrons dans les orbitales 3d sont appariés..
Les références
- Helmenstine, Anne Marie, Ph.D. (15 juin 2017). Définition du principe d'Aufbau. Tiré de: thinkco.com
- Prof. N. De Leon. (2001). Le principe d'Aufbau. Tiré de: iun.edu
- Chimie 301. Principe d'Aufbau. Extrait de: ch301.cm.utexas.edu
- Hozefa Arsiwala et teacherlookup.com. (1 juin 2017). En détail: le principe d'Aufbau avec des exemples. Tiré de: teacherlookup.com
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE, p 199-203.
- Goodphy. (27 juillet 2016). Schéma de Madelung. [Chiffre]. Tiré de: commons.wikimedia.org


Personne n'a encore commenté ce post.