
Structure de l'hydroxyde de mercure, propriétés, utilisations, risques

le hydroxyde de mercure C'est un composé inorganique dans lequel le mercure métallique (Hg) a un indice d'oxydation de 2+. Sa formule chimique est Hg (OH)deux. Cependant, cette espèce n'a pas encore été obtenue sous forme solide dans des conditions normales..
L'hydroxyde de mercure ou l'hydroxyde de mercure est un intermédiaire transitoire de courte durée dans la formation d'oxyde mercurique HgO en solution alcaline. Des études menées dans des solutions d'oxyde mercurique HgO, il a été déduit que Hg (OH)deux c'est une base faible. Les autres espèces qui l'accompagnent sont HgOH+ et le Hgdeux+.

Bien qu'il ne puisse pas être précipité en solution aqueuse, Hg (OH)deux Il a été obtenu par réaction photochimique du mercure avec de l'hydrogène et de l'oxygène à de très basses températures. Il a également été obtenu sous forme de coprécipité avec Fe (OH)3, où la présence d'ions halogénure influence le pH auquel la coprécipitation se produit.
Comme il n'a pas été facilement obtenu pur au niveau du laboratoire, il n'a pas été possible de trouver une utilisation pour ce composé, ni de déterminer les risques de son utilisation. Cependant, on peut en déduire qu'il présente les mêmes risques que les autres composés du mercure.
Index des articles
- 1 Structure de la molécule
- 2 Configuration électronique
- 3 Nomenclature
- 4 propriétés
- 4.1 Poids moléculaire
- 4.2 Propriétés chimiques
- 5 Obtention
- 5.1 Hydroxyde de mercure pur
- 5.2 Coprécipitation avec l'hydroxyde de fer (III)
- 6 utilisations
- 7 Études récentes
- 8 risques
- 9 Références
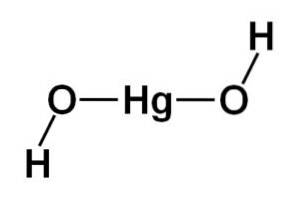
Structure de la molécule
La structure de l'hydroxyde de mercure (II) Hg (OH)deux il est basé sur une partie centrale linéaire formée par l'atome de mercure avec les deux atomes d'oxygène sur les côtés.
Des atomes d'hydrogène sont attachés à cette structure centrale, chacun à côté de chaque oxygène, qui tournent librement autour de chaque oxygène. Il pourrait être représenté de manière simple comme suit:
Configuration électronique
La structure électronique du mercure métallique Hg est la suivante:
[Xe] 5rédix 6sdeux
où [Xe] est la configuration électronique du xénon de gaz rare.
En observant cette structure électronique, on déduit que l'état d'oxydation le plus stable du mercure est celui dans lequel les 2 électrons de la couche 6 sont perdus.s.
Dans l'hydroxyde mercurique Hg (OH)deux, l'atome de mercure (Hg) est dans son état d'oxydation 2+. Par conséquent, dans le Hg (OH)deux le mercure a la configuration électronique suivante:
[Xe] 5rédix
Nomenclature
- Hydroxyde de mercure (II)
- Hydroxyde mercurique
- Dihydroxyde de mercure
Propriétés
Poids moléculaire
236,62 g / mol
Propriétés chimiques
Selon les informations consultées, il est possible que Hg (OH)deux être un composé transitoire dans la formation de HgO en milieu aqueux alcalin.
L'ajout d'ions hydroxyles (OH-) à une solution aqueuse d'ions mercuriques Hgdeux+ conduit à la précipitation d'un solide jaune d'oxyde de mercure (II) HgO, dont Hg (OH)deux est un agent temporaire ou temporaire.

En solution aqueuse Hg (OH)deux C'est un intermédiaire de très courte durée, car il libère rapidement une molécule d'eau et précipite du HgO solide.
Bien qu'il n'ait pas été possible de précipiter l'hydroxyde mercurique Hg (OH)deux, l'oxyde de mercure (II) HgO est quelque peu soluble dans l'eau, formant une solution d'espèces appelées «hydroxydes».
Ces espèces dans l'eau appelées «hydroxydes» sont des bases faibles et, bien qu'elles se comportent parfois comme des amphotères, en général Hg (OH)deux c'est plus basique que l'acide.
Lorsque HgO se dissout dans HClO4 des études indiquent la présence d'ions mercuriques Hgdeux+, un ion monohydroxymercurique HgOH+ et hydroxyde mercurique Hg (OH)deux.
Les équilibres qui se produisent dans de telles solutions aqueuses sont les suivants:
Hgdeux+ + HdeuxO ⇔ HgOH+ + H+
HgOH+ + HdeuxO ⇔ Hg (OH)deux + H+
Dans les solutions alcalines de NaOH, l'espèce Hg (OH) se forme3-.
Obtention
Hydroxyde de mercure pur
Hydroxyde de mercure (II) Hg (OH)deux Il ne peut pas être obtenu en solution aqueuse, car lors de l'ajout d'alcali à une solution d'ions mercuriques Hgdeux+, précipité d'oxyde mercurique jaune HgO.
Cependant, certains chercheurs ont réussi à obtenir de l'hydroxyde mercurique Hg (OH) pour la première fois en 2005deux utilisant une lampe à arc au mercure, à partir de l'élément mercure Hg, hydrogène Hdeux et oxygène Odeux.

La réaction est photochimique et a été réalisée en présence de néon solide, d'argon ou de deutérium à de très basses températures (environ 5 K = 5 degrés Kelvin). La preuve de la formation du composé a été obtenue par des spectres d'absorption de lumière IR (infrarouge).
Hg (OH)deux préparé de cette manière, il est très stable dans les conditions de l'expérience. On estime que la réaction photochimique passe par l'intermédiaire O-Hg-O à la molécule stable H-O-Hg-O-H.
Coprécipitation avec l'hydroxyde de fer (III)
Si le sulfate de mercure (II) HgSO se dissout4 et sulfate de fer (III) Fedeux(SW4)3 dans une solution aqueuse acide, et le pH commence à augmenter en ajoutant une solution d'hydroxyde de sodium NaOH, après un temps de repos, il se forme un solide qui est supposé être un coprécipité de Hg (OH)deux et Fe (OH)3.
Il a été constaté que la formation de Hg (OH)deux est une étape critique de cette coprécipitation avec Fe (OH)3.
La formation de Hg (OH)deux dans le précipité Fe (OH)3-Hg (OH)deux dépend fortement de la présence d'ions tels que fluorure, chlorure ou bromure, de leur concentration spécifique et du pH de la solution.
En présence de fluor (F-), à pH supérieur à 5, la coprécipitation de Hg (OH)deux avec Fe (OH)3 il n'est pas affecté. Mais à un pH de 4, la formation de complexes entre Hgdeux+ et le F- interfère avec la coprécipitation de Hg (OH)deux.
En cas de présence de chlorure (Cl-), la coprécipitation de Hg (OH)deux se produit à un pH de 7 ou plus, c'est-à-dire de préférence dans un milieu alcalin.
Lorsque le bromure (Br-), la coprécipitation de Hg (OH)deux se produit à un pH encore plus élevé, c'est-à-dire un pH supérieur à 8,5, ou plus alcalin qu'avec le chlorure.
Applications
De l'examen des sources d'informations disponibles, il est déduit que l'hydroxyde de mercure (II) Hg (OH)deux, Étant un composé pas encore préparé commercialement, il n'a pas d'utilisations connues.
Des études récentes
À l'aide de techniques de simulation informatique en 2013, les caractéristiques structurelles et énergétiques liées à l'hydratation du Hg (OH) ont été étudiées.deux à l'état gazeux.
Les énergies de coordination et de solvatation métal-ligand ont été calculées et comparées en faisant varier le degré d'hydratation du Hg (OH)deux.
Entre autres choses, il a été constaté qu'apparemment, l'état d'oxydation théorique est 1+ au lieu du 2+ présumé habituellement attribué pour Hg (OH)deux.
Des risques
Bien que Hg (OH)deux en tant que tel, il n'a pas été isolé en quantité suffisante et n'a donc pas été utilisé commercialement, ses risques spécifiques n'ont pas été déterminés, mais on peut en déduire qu'il présente les mêmes risques que le reste des sels de mercure.
Il peut être toxique pour le système nerveux, le système digestif, la peau, les yeux, le système respiratoire et les reins..
L'inhalation, l'ingestion ou le contact avec la peau de composés du mercure peuvent causer des dommages allant de l'irritation des yeux et de la peau, de l'insomnie, des maux de tête, des tremblements, des lésions du tractus intestinal, des pertes de mémoire, à l'insuffisance rénale, entre autres symptômes.
Le mercure a été reconnu internationalement comme polluant. La plupart des composés de mercure qui entrent en contact avec l'environnement sont méthylés par des bactéries présentes dans les sols et les sédiments, formant du méthylmercure.
Ce composé se bioaccumule dans les organismes vivants, passant du sol aux plantes et de là aux animaux. Dans le milieu aquatique, le transfert est encore plus rapide, passant de très petites à grandes espèces en peu de temps.
Le méthylmercure a un effet toxique pour les êtres vivants et en particulier pour les humains, qui l'ingèrent à travers la chaîne alimentaire.
Lorsqu'il est ingéré avec de la nourriture, il est particulièrement nocif pour les jeunes enfants et les fœtus chez les femmes enceintes, car étant une neurotoxine, il peut endommager le cerveau et le système nerveux en formation et en croissance..
Les références
- Cotton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley et fils.
- Wang, Xuefeng et Andrews, Lester (2005). Spectre infrarouge de Hg (OH)deux en néon solide et argon. Chimie inorganique, 2005, 44, 108-113. Récupéré de pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Solvation aqueuse de Hg (OH)deux: Études de théorie fonctionnelle de la densité énergétique et dynamique du Hg (OH)deux-(HdeuxOU ALORS)n (n = 1-24) Structures. J. Phys. Chem. A 2013, 117, 9069-9075. Récupéré de pubs.acs.org.
- Inoue, Yoshikazu et Munemori, Makoto. (1979). Coprécipitation de mercure (II) avec de l'hydroxyde de fer (III). Science et technologie de l'environnement. Volume 13, numéro 4, avril 1979. Récupéré de pubs.acs.org.
- Chang, L. W., et al. (2010). Système nerveux et toxicologie comportementale. En toxicologie complète. Récupéré de sciencedirect.com.
- Haney, Alan et Lipsey, Richard L. (1973). Accumulation et effets de l'hydroxyde de méthylmercure dans une chaîne alimentaire terrestre dans des conditions de laboratoire. Environ. Pollut. (5) (1973) pp. 305-316. Récupéré de sciencedirect.com.



Personne n'a encore commenté ce post.