
Parties et exemples d'équations chimiques

La équation chimique c'est une représentation schématique de certaines des caractéristiques d'une réaction chimique. On peut également dire que l'équation chimique décrit les changements subis par les différentes substances impliquées dans une réaction.
Les formules et symboles des différentes substances participantes sont placés dans l'équation chimique, indiquant clairement le nombre d'atomes de chaque élément présent dans les composés, qui apparaît en indice et ne peut pas être changé en équilibrant l'équation.
L'équation chimique doit apparaître équilibrée, c'est-à-dire que le nombre d'atomes des réactifs et des produits doit être égal. De cette manière, la loi de conservation de la matière est respectée. Il est souhaitable que les nombres utilisés pour équilibrer les équations soient des nombres entiers.
Ces équations ne révèlent pas les étapes consécutives, ni par quels mécanismes les réactifs sont transformés en produits..
C'est pourquoi, bien qu'ils soient très utiles pour comprendre où va une réaction chimique, cela ne nous permet pas de comprendre ses aspects moléculaires ou comment elle est affectée par certaines variables; tels que le pH, la viscosité, le temps de réaction, la vitesse d'agitation, entre autres.
Index des articles
- 1 Parties d'une équation chimique
- 1.1 Emplacement des réactifs et des produits
- 1.2 Équilibrage des équations chimiques
- 1.3 États physiques des composants de l'équation chimique
- 1.4 Changements d'état physique
- 2 Exemple d'équations chimiques
- 2.1 - Photosynthèse
- 2.2 - Respiration cellulaire
- 2.3 - Réactions des éléments communs
- 3 Références
Parties d'une équation chimique
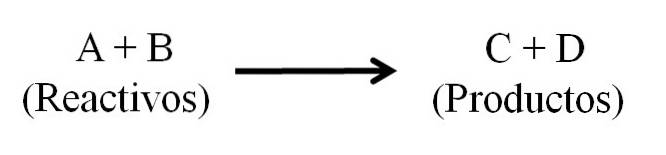
Une équation chimique comprend essentiellement trois parties principales: les réactifs, les produits et la flèche qui indique la direction de la réaction chimique..
Emplacement des réactifs et des produits
Toutes les substances qui fonctionnent comme des réactifs et toutes celles qui sont des produits apparaissent dans l'équation chimique. Ces groupes de substances sont séparés par une flèche qui indique le sens de la réaction. Les réactifs sont situés à gauche de la flèche et les produits à droite.
La flèche signifie ce qui est produit et est orientée de gauche à droite (→), bien que dans les réactions réversibles il y ait deux flèches équivalentes et parallèles; un dirigé vers la droite et un vers la gauche. Le symbole (Δ) est généralement placé au-dessus de la flèche, indiquant que la chaleur a été utilisée dans la réaction..
De plus, l'identification du catalyseur est généralement placée sur la flèche, si possible avec sa formule ou son symbole. Les différentes substances qui apparaissent comme réactifs sont séparées par le signe (+), indiquant que les substances réagissent ou se combinent entre elles.
Dans le cas de substances qui apparaissent comme des produits, le signe (+) n'a pas la connotation précédente; sauf si la réaction est réversible. Il est pratique que le signe (+) soit placé à égale distance des substances qu'il sépare.
Équilibrer les équations chimiques
Il est essentiel que les équations chimiques soient correctement équilibrées. Pour cela, un nombre appelé coefficient stoechiométrique est placé. Chaque fois que nécessaire, ce coefficient doit passer avant les substances qui apparaissent comme réactifs ou produits..
Ceci afin de parvenir à ce que le nombre de tous les atomes des éléments qui apparaissent comme réactifs soit exactement égal au nombre d'entre eux qui apparaissent dans le produit. La méthode la plus simple pour équilibrer les équations chimiques est l'essai et l'erreur..
États physiques des composants de l'équation chimique
Dans certaines équations chimiques, l'état physique des substances est marqué d'un indice. Pour cela, les abréviations suivantes sont utilisées en espagnol: (s) pour l'état solide; (l) pour l'état liquide; (g), à l'état gazeux; et (ac), solution aqueuse.
Exemple: réaction du carbonate de calcium avec de l'acide chlorhydrique.
Voleur3 (s) + 2 HCl(ac) → CaCl2 (s) + HdeuxOU ALORS(l) + CO2 g)
Changements d'état physique
Dans certains cas, il est indiqué dans l'équation chimique s'il y a production d'un gaz dans la réaction chimique ou s'il y a précipitation de l'une des substances produites.
La présence d'un gaz est indiquée par une flèche verticale avec son extrémité dirigée vers le haut (↑), placée sur le côté droit de la substance gazeuse.
Exemple: réaction du zinc avec l'acide chlorhydrique.
Zn + 2 HCl → ZnCldeux + Hdeux↑
Si dans la réaction chimique l'une des substances forme un précipité, cela est symbolisé en plaçant une flèche verticale avec son extrémité dirigée vers le bas (↓), placée sur le côté droit de la substance précipitée..
Exemple: réaction de l'acide chlorhydrique avec du nitrate d'argent.
HCl + AgNO3 → HNO3 + AgCl ↓
Exemple d'équations chimiques
- Photosynthèse

La photosynthèse est un processus par lequel les plantes captent et transforment l'énergie lumineuse, provenant de la lumière du soleil, pour générer l'énergie nécessaire à leur subsistance. La photosynthèse est réalisée par certains organites de cellules végétales appelées chloroplastes.
Les thylakoïdes se trouvent dans la membrane chloroplastique, sites où se trouvent des chlorophylles. à Oui b, qui sont les principaux pigments qui captent l'énergie lumineuse.
Bien que la photosynthèse soit un processus complexe, elle peut être décrite dans l'équation chimique suivante:
6 COdeux + 6 heuresdeuxO → C6H12OU ALORS6 + 6 Odeux↑ ΔGº = 2 870 kJ / mol
C6H12OU ALORS6 C'est la formule du glucose, un glucide métabolisé pour la production d'ATP; composé qui est le principal réservoir d'énergie dans la plupart des êtres vivants. De plus, le NADPH est généré à partir du glucose, une coenzyme nécessaire à de nombreuses réactions..
- Respiration cellulaire
Les cellules utilisent l'oxygène pour le métabolisme de nombreuses substances présentes dans les aliments ingérés. Pendant ce temps, l'ATP est utilisé comme source d'énergie pour les activités menées par les êtres vivants, produisant du dioxyde de carbone et de l'eau dans ces processus..
Si le glucose est utilisé comme modèle pour une substance métabolisée, la respiration peut être schématisée à l'aide de l'équation chimique suivante:
C6H12OU ALORS6 + 6 Odeux → 6 COdeux + 6 heuresdeuxOU ALORS
- Réactions communes aux éléments
Réaction de décomposition
Un ou plusieurs composés se dissocient, formant d'autres composés différents avec leurs atomes:
2 KClO3 (s) → 2 KCl(s) + 3 O2 g)
Réaction de déplacement
Un métal réagit avec un composé en remplaçant un métal qu'il contient:
Mg(s) + COURS4 (ac) → Cu(s) + MgSO4 (ac)
Réaction d'élimination
Dans ce type de réaction, le nombre d'atomes ou de groupes attachés à un atome de carbone diminue:
CH3-CHdeuxBr + NaOH → HdeuxC = CHdeux + HdeuxO + NaBr
Réaction d'hydratation
C'est une réaction dans laquelle un composé ajoute une molécule d'eau. Cette réaction est importante dans la préparation des alcools:
HdeuxC = CHdeux + HdeuxO → HdeuxC-CHdeuxOh
Réaction de neutralisation
Une base ou un alcali réagit avec un acide produisant un sel et de l'eau:
HCl(ac) + NaOH(ac) → NaCl(ac) + HdeuxOU ALORS(l)
Réaction de synthèse
Dans ce type de réaction, deux substances ou plus sont combinées pour créer un nouveau composé:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Réaction de double déplacement (métathèse)
Dans ce type de réaction, il y a échange d'ions positifs et négatifs pour former de nouveaux composés:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Grand frère3 (ac)
Les références
- Flores, J. (2002). Chimie. Édition 1était. Éditorial Santillana
- Mathews, C. K., Van Holde, K. E. et Ahern, K. G. (2002). Biochimie. 3était Édition. Éditeur Pearson Addison Wesley
- Whitten, Davis, Peck et Stanley. (2008). Chimie. (8e éd.). Apprentissage CENGAGE.
- Wikipédia. (2019). Équation chimique. Récupéré de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20 septembre 2019). Qu'est ce qu'une equation chimique? Récupéré de: thinkco.com

Personne n'a encore commenté ce post.