
Échelles d'électronégativité, variation, utilité et exemples

La électronégativité c'est une propriété périodique relative qui concerne la capacité d'un atome à attirer la densité électronique de son environnement moléculaire. C'est la tendance d'un atome à attirer des électrons lorsqu'il est attaché à une molécule. Cela se reflète dans le comportement de nombreux composés et dans la manière dont ils interagissent de manière intermoléculaire les uns avec les autres..
Tous les éléments n'attirent pas les électrons des atomes adjacents au même degré. Dans le cas de ceux qui donnent facilement la densité électronique, on dit qu'ils sont électropositif, tandis que ceux qui sont «couverts» d'électrons sont électronégatif. Il existe de nombreuses façons d'expliquer et d'observer cette propriété (ou concept).
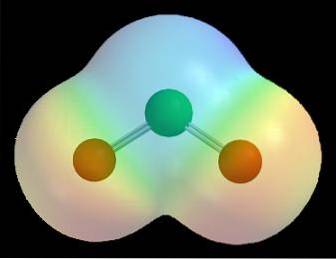
Par exemple, dans les cartes de potentiel électrostatique d'une molécule (comme celle du dioxyde de chlore dans l'image ci-dessus, ClOdeux) on observe l'effet des différentes électronégativités pour les atomes de chlore et d'oxygène.
La couleur rouge indique les régions riches en électrons de la molécule, δ-, et la couleur bleue indique les régions pauvres en électrons, δ +. Ainsi, après une série de calculs informatiques, ce type de carte peut être établi; beaucoup d'entre eux montrent une relation directe entre l'emplacement des atomes électronégatifs et δ-.
Il peut également être visualisé comme suit: au sein d'une molécule, le transit des électrons est plus susceptible de se produire au voisinage des atomes les plus électronégatifs. C'est pour cette raison que pour ClOdeux les atomes d'oxygène (les sphères rouges) sont entourés d'un nuage rouge, tandis que l'atome de chlore (la sphère verte) est entouré d'un nuage bleuâtre.
La définition de l'électronégativité dépend de l'approche donnée au phénomène, il existe plusieurs échelles qui le considèrent sous certains aspects. Cependant, toutes les échelles ont en commun d'être soutenues par la nature intrinsèque des atomes.
Index des articles
- 1 Échelles d'électronégativité
- 1.1 Échelle de Pauling
- 1.2 Échelle Mulliken
- 1.3 Échelle de A.L. Allred et E. Rochow
- 2 Comment l'électronégativité varie-t-elle sur le tableau périodique?
- 2.1 L'atome dans la molécule
- 3 À quoi ça sert?
- 4 Exemples (chlore, oxygène, sodium, fluor)
- 5 Références
Échelles d'électronégativité
L'électronégativité n'est pas une propriété qui peut être quantifiée et elle n'a pas de valeurs absolues. Parce que? Parce que la tendance d'un atome à attirer la densité électronique vers lui n'est pas la même dans tous les composés. En d'autres termes: l'électronégativité varie en fonction de la molécule.
Oui pour la molécule ClOdeux Si l'atome Cl était échangé contre l'atome N, alors la tendance de O à attirer les électrons changerait également; il pourrait augmenter (rendre le nuage plus rouge) ou diminuer (perdre de la couleur). La différence résiderait dans la nouvelle liaison N-O formée, pour avoir ainsi la molécule O-N-O (dioxyde d'azote, NOdeux).
Comme l'électronégativité d'un atome n'est pas la même pour tout son environnement moléculaire, il est nécessaire de le définir en termes d'autres variables. De cette manière, il existe des valeurs qui servent de référence et qui permettent de prédire, par exemple, le type de liaison qui se forme (ionique ou covalente).
Échelle de Pauling
Le grand scientifique et lauréat de deux prix Nobel, Linus Pauling, proposa en 1932 une forme quantitative (mesurable) de l'électronégative connue sous le nom d'échelle de Pauling. Dans celui-ci, l'électronégativité de deux éléments, A et B, formant des liaisons, était liée à l'énergie supplémentaire associée au caractère ionique de la liaison A-B.
Comment est-ce? Théoriquement, les liaisons covalentes sont les plus stables, car la distribution de leurs électrons entre deux atomes est équitable; c'est-à-dire que pour les molécules A-A et B-B, les deux atomes partagent la paire d'électrons de la liaison de la même manière. Cependant, si A est plus électronégatif, alors ladite paire sera plus de A que de B.
Dans ce cas, A-B n'est plus complètement covalent, bien que si leurs électronégativités ne diffèrent pas beaucoup, on peut dire que leur liaison a un caractère covalent élevé. Lorsque cela se produit, la liaison subit une petite instabilité et acquiert une énergie supplémentaire en tant que produit de la différence d'électronégativité entre A et B.
Plus cette différence est grande, plus l'énergie de la liaison A-B est grande, et par conséquent plus le caractère ionique de ladite liaison est important..
Cette échelle représente la plus utilisée en chimie, et les valeurs d'électronégativités sont issues de l'attribution d'une valeur de 4 à l'atome de fluor. De là, ils pourraient calculer celui des autres éléments.
Échelle Mulliken
Alors que l'échelle de Pauling a à voir avec l'énergie associée aux liaisons, l'échelle de Robert Mulliken est plus liée à deux autres propriétés périodiques: l'énergie d'ionisation (EI) et l'affinité électronique (AE).
Ainsi, un élément avec des valeurs EI et AE élevées est très électronégatif et attirera donc les électrons de son environnement moléculaire..
Parce que? Parce que EI reflète à quel point il est difficile de "déchirer" un électron externe de celui-ci, et AE à quel point l'anion formé dans la phase gazeuse est stable. Si les deux propriétés ont des magnitudes élevées, alors l'élément est "amoureux" des électrons..
Les électronégativités Mulliken sont calculées avec la formule suivante:
ΧM = ½ (EI + AE)
Autrement dit, χM équivaut à la valeur moyenne de EI et AE.
Cependant, contrairement à l'échelle de Pauling qui dépend des atomes qui forment des liaisons, elle est liée aux propriétés de l'état de valence (avec ses configurations électroniques les plus stables).
Les deux échelles génèrent des valeurs d'électronégativité similaires pour les éléments et sont approximativement liées à la reconversion suivante:
ΧP = 1,35 (ΧM)1/2 - 1,37
Les deux XM comme XP ce sont des valeurs sans dimension; c'est-à-dire qu'ils manquent d'unités.
Échelle de A.L. Allred et E. Rochow
Il existe d'autres échelles d'électronégativité, telles que les échelles de Sanderson et Allen. Cependant, celle qui suit les deux premiers est l'échelle d'Allred et Rochow (χAR). Cette fois, il est basé sur la charge nucléaire effective qu'un électron subit à la surface des atomes. Par conséquent, il est directement lié à la force attractive du noyau et à l'effet d'écran..
Comment l'électronégativité varie-t-elle sur le tableau périodique?
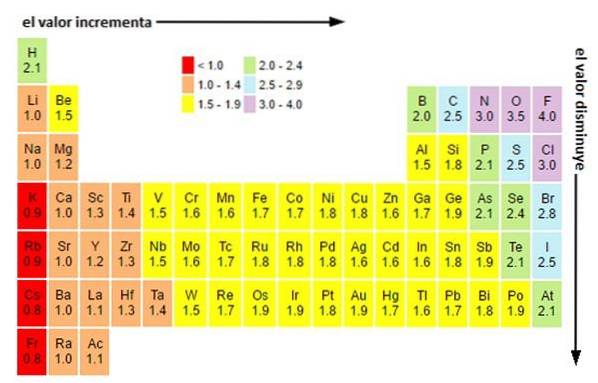
Quelles que soient les échelles ou les valeurs que vous avez, l'électronégativité augmente de droite à gauche pendant une période et de bas en haut dans les groupes. Ainsi, il augmente vers la diagonale supérieure droite (sans compter l'hélium) jusqu'à ce qu'il rencontre le fluor.
Dans l'image ci-dessus, vous pouvez voir ce qui vient d'être dit. Dans le tableau périodique, les électronégativités de Pauling sont exprimées en fonction des couleurs des cellules. Puisque le fluor est le plus électronégatif, il a une couleur violette plus proéminente, tandis que les couleurs les moins électronégatives (ou électropositives) sont plus foncées..
De même, on peut observer que les têtes de groupes (H, Be, B, C, etc.) ont des couleurs plus claires, et qu'à mesure que l'on descend dans le groupe, les autres éléments s'assombrissent. Ca parle de quoi? La réponse est à nouveau à la fois dans les propriétés EI, AE, Zef (charge nucléaire effective) et dans le rayon atomique.
L'atome dans la molécule
Les atomes individuels ont une charge nucléaire réelle Z et les électrons externes subissent une charge nucléaire efficace en raison de l'effet de blindage..
En se déplaçant sur une période, Zef augmente de telle sorte que l'atome se contracte; c'est-à-dire que les rayons atomiques sont réduits sur une période.
Ceci a pour conséquence qu'au moment de la liaison d'un atome avec un autre, les électrons «couleront» vers l'atome avec le Zef le plus élevé. En outre, cela donne un caractère ionique à la liaison s'il y a une tendance marquée des électrons à aller vers un atome. Quand ce n'est pas le cas, on parle alors d'une liaison majoritairement covalente.
Pour cette raison, l'électronégativité varie en fonction des rayons atomiques, Zef, qui à leur tour sont étroitement liés à EI et AE. Tout est une chaîne.
Pourquoi est-ce?
À quoi sert l'électronégativité? En principe pour déterminer si un composé binaire est covalent ou ionique. Lorsque la différence d'électronégativité est très élevée (à un taux de 1,7 unité ou plus), le composé est dit ionique. Il est également utile de discerner dans une structure quelles régions sont susceptibles d'être plus riches en électrons..
À partir de là, le mécanisme ou la réaction que le composé peut subir peut être prédit. Dans les régions pauvres en électrons, δ +, les espèces chargées négativement peuvent agir d'une certaine manière; et dans les régions riches en électrons, leurs atomes peuvent interagir de manière très spécifique avec d'autres molécules (interactions dipôle-dipôle).
Exemples (chlore, oxygène, sodium, fluor)
Quelles sont les valeurs d'électronégativité des atomes de chlore, d'oxygène, de sodium et de fluor? Après le fluor, qui est le plus électronégatif? En utilisant le tableau périodique, on observe que le sodium a une couleur pourpre foncé, tandis que les couleurs de l'oxygène et du chlore sont visuellement très similaires..
Ses valeurs d'électronégativité pour les échelles de Pauling, Mulliken et Allred-Rochow sont:
Na (0,93, 1,21, 1,01).
Ou (3.44, 3.22, 3.50).
Cl (3,16, 3,54, 2,83).
F (3,98, 4,43, 4,10).
Notez qu'avec les valeurs numériques une différence est observée entre les négativités de l'oxygène et du chlore.
Selon l'échelle de Mulliken, le chlore est plus électronégatif que l'oxygène, contrairement aux échelles de Pauling et Allred-Rochow. La différence d'électronégativité entre les deux éléments est encore plus évidente en utilisant l'échelle d'Allred-Rochow. Et enfin, le fluor quelle que soit l'échelle choisie est le plus électronégatif..
Par conséquent, là où il y a un atome F dans une molécule, cela signifie que la liaison aura un caractère ionique élevé..
Les références
- Shiver et Atkins. (2008). Chimie inorganique. (Quatrième édition., Pages 30 et 44). Mc Graw Hill.
- Jim Clark. (2000). Électronégativité. Tiré de: chemguide.co.uk
- Anne Marie Helmenstine, Ph.D. (11 décembre 2017). Définition et exemples d'électronégativité. Tiré de: thinkco.com
- Mark E. Tuckerman. (5 novembre 2011). Échelle d'électronégativité. Tiré de: nyu.edu
- Wikipédia. (2018). Électronégativité. Tiré de: es.wikipedia.org



Personne n'a encore commenté ce post.