
Caractéristiques des liaisons chimiques, comment elles sont formées, types
le Liaison chimique c'est la force qui parvient à maintenir ensemble les atomes qui composent la matière. Chaque type de matière a une liaison chimique caractéristique, qui consiste en la participation d'un ou plusieurs électrons. Ainsi, les forces qui unissent les atomes dans les gaz sont différentes, par exemple, des métaux.
Tous les éléments du tableau périodique (à l'exception de l'hélium et des gaz rares légers) peuvent former des liaisons chimiques entre eux. Cependant, la nature de ceux-ci est modifiée en fonction des éléments dont proviennent les électrons qui les forment. Un paramètre essentiel pour expliquer le type de liaisons est l'électronégativité.
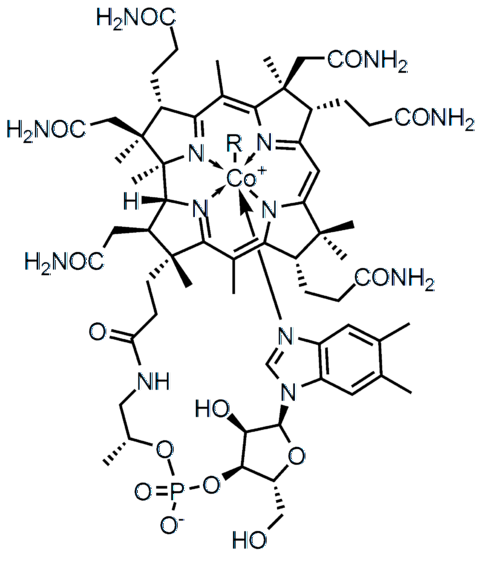
La différence d'électronégativité (ΔE) entre deux atomes définit non seulement le type de liaison chimique, mais également les propriétés physico-chimiques du composé. Les sels sont caractérisés en ce qu'ils ont des liaisons ioniques (ΔE élevé) et de nombreux composés organiques, tels que la vitamine B12 (image du haut), liaisons covalentes (ΔE faible).
Dans la structure moléculaire supérieure, chacune des lignes représente une liaison covalente. Les coins indiquent que le lien émerge de l'avion (vers le lecteur), et les soulignés derrière l'avion (loin du lecteur). Notez qu'il y a des doubles liaisons (=) et un atome de cobalt coordonné avec cinq atomes d'azote et une chaîne latérale R.
Mais pourquoi de telles liaisons chimiques se forment-elles? La réponse réside dans la stabilité énergétique des atomes et électrons participants. Cette stabilité doit équilibrer les répulsions électrostatiques subies entre les nuages d'électrons et les noyaux, et l'attraction exercée par un noyau sur les électrons de l'atome voisin..
Index des articles
- 1 Définition de la liaison chimique
- 2 caractéristiques
- 3 Comment se forment les liaisons chimiques?
- 3.1 Composés homonucléaires A-A
- 3.2 Composés hétéronucléaires A-B
- 4 Types de liaisons chimiques
- 4.1 - Liaison covalente
- 4.2 - Liaison ionique
- 4.3 Liaison métallique
- 5 Exemples de liens
- 6 Importance de la liaison chimique
- 7 Références
Définition de la liaison chimique
De nombreux auteurs ont donné des définitions de la liaison chimique. De tous ceux-ci, le plus important était celui du physicochimiste G. N. Lewis, qui définissait la liaison chimique comme la participation d'une paire d'électrons entre deux atomes. Si les atomes A et B peuvent apporter un seul électron, alors la liaison simple A: B ou A-B se formera entre eux.
Avant la formation de la liaison, A et B sont séparés par une distance indéfinie, mais lors de la liaison, il y a maintenant une force qui les maintient ensemble dans le composé diatomique AB et une distance de liaison (ou longueur).
Caractéristiques
Quelles sont les caractéristiques de cette force qui maintient les atomes ensemble? Celles-ci dépendent plus du type de lien entre A et B que de leurs structures électroniques. Par exemple, la liaison A-B est directionnelle. Que voulez-vous dire? Que la force exercée par l'union de la paire d'électrons peut être représentée sur un axe (comme s'il s'agissait d'un cylindre).
En outre, ce lien nécessite de l'énergie pour se rompre. Cette quantité d'énergie peut être exprimée en unités de kJ / mol ou cal / mol. Une fois que suffisamment d'énergie a été appliquée au composé AB (par la chaleur, par exemple), il se dissociera en les atomes A et B. d'origine..
Plus la liaison est stable, plus il faut d'énergie pour séparer les atomes liés..
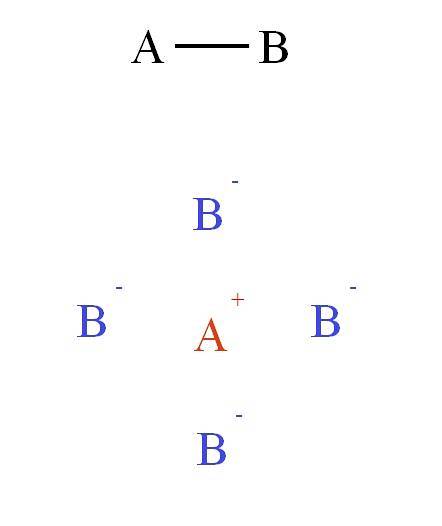
Par contre, si la liaison dans le composé AB était ionique, A+B-, alors ce serait une force non directionnelle. Parce que? Parce que+ exerce une force attractive sur B- (et vice versa) qui dépend plus de la distance qui sépare les deux ions dans l'espace que de leur emplacement relatif.
Ce champ d'attraction et de répulsion rassemble d'autres ions pour former ce qu'on appelle le réseau cristallin (image du haut: cation A+ se trouve entouré de quatre anions B-, et ces quatre cations A+ et ainsi de suite).
Comment se forment les liaisons chimiques?
Composés homonucléaires A-A
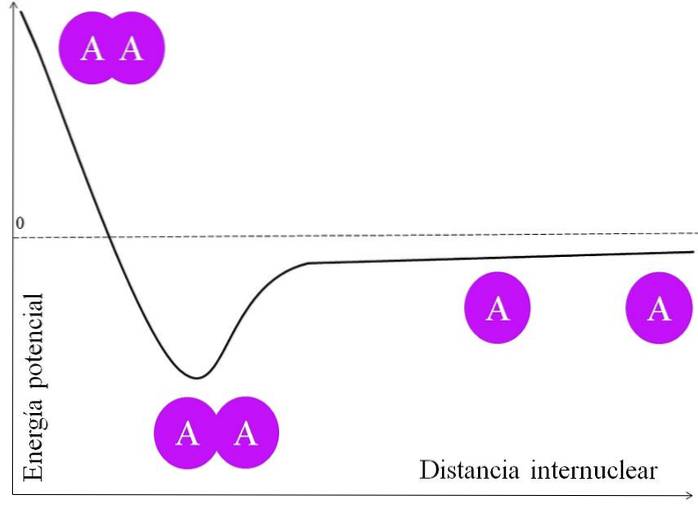
Pour qu'une paire d'électrons forme une liaison, il y a beaucoup de choses à considérer en premier. Les noyaux, pour dire ceux de A, ont des protons et sont donc positifs. Lorsque deux atomes A sont très éloignés l'un de l'autre, c'est-à-dire à une grande distance internucléaire (image du haut), ils ne subissent aucune attraction.
Au fur et à mesure que les deux atomes A s'approchent de leur noyau, ils attirent le nuage d'électrons de l'atome voisin (le cercle violet). C'est la force d'attraction (A sur le cercle violet voisin). Cependant, les deux noyaux de A se repoussent car ils sont positifs, et cette force augmente l'énergie potentielle de la liaison (axe vertical).
Il y a une distance internucléaire dans laquelle l'énergie potentielle atteint un minimum; c'est-à-dire que les forces attractives et répulsives sont équilibrées (les deux atomes A dans la partie inférieure de l'image).
Si cette distance diminue après ce point, la liaison amènera les deux noyaux à se repousser avec une grande force, déstabilisant le composé A-A..
Donc, pour que le lien se forme, il doit y avoir une distance internucléaire énergétiquement adéquate; et de plus, les orbitales atomiques doivent se chevaucher correctement pour que les électrons se lient.
Composés hétéronucléaires A-B
Et si au lieu de deux atomes de A, l'un de A et l'autre de B se rejoignaient? Dans ce cas, le graphique supérieur changerait car l'un des atomes aurait plus de protons que l'autre et les nuages d'électrons auraient des tailles différentes..
Comme la liaison A-B est formée à la distance internucléaire appropriée, la paire d'électrons se trouvera principalement à proximité de l'atome le plus électronégatif. C'est le cas de tous les composés chimiques hétéronucléaires, qui constituent la grande majorité de ceux qui sont connus (et seront connus).
Bien que cela ne soit pas mentionné en détail, il existe de nombreuses variables qui influencent directement l'approche des atomes et la formation des liaisons chimiques; certains sont thermodynamiques (la réaction est-elle spontanée?), électroniques (à quel point les orbitales des atomes sont-elles pleines ou vides) et d'autres cinétiques.
Types de liaisons chimiques
Les liens ont une série de caractéristiques qui les distinguent les uns des autres. Plusieurs d'entre eux peuvent être encadrés dans trois classifications principales: covalente, ionique ou métallique.
Bien qu'il existe des composés dont les liaisons appartiennent à un seul type, beaucoup consistent en fait en un mélange de caractères de chacun. Ce fait est dû à la différence d'électronégativité entre les atomes qui forment les liaisons. Ainsi, certains composés peuvent être covalents, mais ont un certain caractère ionique dans leurs liaisons..
De même, le type de liaison, la structure et la masse moléculaire sont des facteurs clés qui définissent les propriétés macroscopiques de la matière (brillance, dureté, solubilité, point de fusion, etc.).
-Une liaison covalente
Les liaisons covalentes sont celles qui ont été expliquées jusqu'à présent. En eux, deux orbitales (un électron dans chacune) doivent se chevaucher avec les noyaux séparés à une distance internucléaire appropriée..
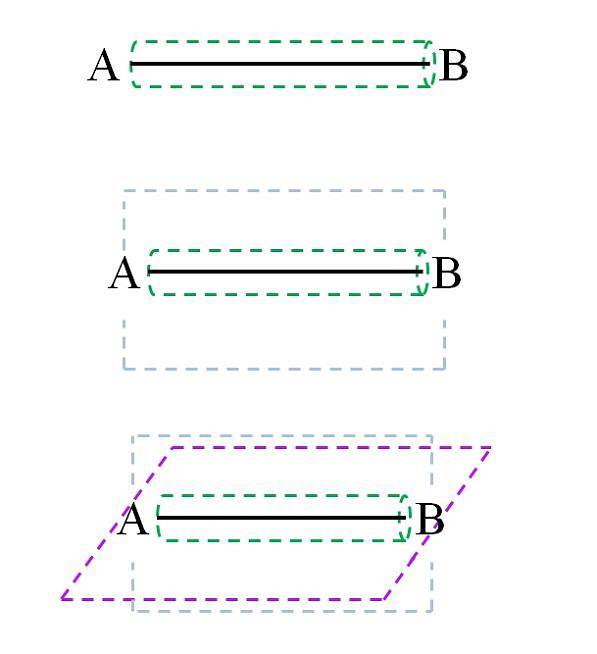
Selon la théorie des orbitales moléculaires (TOM), si le chevauchement des orbitales est frontal, une liaison sigma σ se formera (également appelée liaison simple ou simple). Alors que si les orbitales sont formées par des chevauchements latéraux et perpendiculaires par rapport à l'axe internucléaire, nous aurons les liaisons π (double et triple):
Lien simple
La liaison σ, comme on peut le voir sur l'image, est formée le long de l'axe internucléaire. Bien que non représentés, A et B peuvent avoir d'autres liaisons, et donc leurs propres environnements chimiques (différentes parties de la structure moléculaire). Ce type de lien se caractérise par sa puissance de rotation (cylindre vert) et pour être le plus solide de tous.
Par exemple, la liaison simple dans la molécule d'hydrogène peut tourner sur l'axe internucléaire (H-H). De même, une molécule hypothétique CA-AB peut le faire..
Les liens C-A, A-A et A-B tournent; mais si C ou B sont des atomes ou un groupe d'atomes volumineux, la rotation A-A est stériquement empêchée (car C et B entreraient en collision).
Les liaisons simples se trouvent dans pratiquement toutes les molécules. Leurs atomes peuvent avoir n'importe quelle hybridation chimique tant que le chevauchement de leurs orbitales est frontal. Revenir à la structure de la vitamine B12, une seule ligne (-) indique un lien unique (par exemple, des liens -CONHdeux).
Double lien
La double liaison nécessite que les atomes aient (généralement) une hybridation spdeux. La liaison p pure, perpendiculaire aux trois orbitales hybrides spdeux, forme la double liaison, qui apparaît comme une feuille grisâtre.
Notez que la liaison simple (cylindre vert) et la double liaison (feuille grise) coexistent en même temps. Cependant, contrairement aux liaisons simples, les doubles liaisons n'ont pas la même liberté de rotation autour de l'axe internucléaire. En effet, pour tourner, le lien (ou la feuille) doit se rompre; processus qui a besoin d'énergie.
De plus, la liaison A = B est plus réactive que A-B. Sa longueur est plus courte et les atomes A et B sont à une distance internucléaire plus courte; par conséquent, il y a une plus grande répulsion entre les deux noyaux. Briser les liaisons simples et doubles nécessite plus d'énergie qu'il n'en faut pour séparer les atomes de la molécule A-B..
Dans la structure de la vitamine B12 plusieurs doubles liaisons peuvent être observées: C = O, P = O, et au sein des cycles aromatiques.
Triple liaison
La triple liaison est encore plus courte que la double liaison et sa rotation est plus entravée énergiquement. Dans celui-ci, deux liaisons π perpendiculaires sont formées (les feuilles grisâtres et violettes), ainsi qu'une simple liaison.
Ordinairement, l'hybridation chimique des atomes de A et B doit être sp: deux orbitales sp distantes de 180º, et deux orbitales p pures perpendiculaires à la première. Notez qu'une triple liaison ressemble à une pagaie, mais sans puissance de rotation. Cette liaison peut être représentée simplement par A≡B (N≡N, molécule d'azote Ndeux).
De toutes les liaisons covalentes, c'est la plus réactive; mais en même temps, celui qui a besoin de plus d'énergie pour la séparation complète de ses atomes (· A: +: B ·). Si la vitamine B12 avait une triple liaison au sein de sa structure moléculaire, son effet pharmacologique changerait radicalement.
Six électrons participent à des triples liaisons; en double, quatre électrons; et dans le simple ou simple, deux.
La formation d'une ou plusieurs de ces liaisons covalentes dépend de la disponibilité électronique des atomes; c'est-à-dire de combien d'électrons leurs orbitales ont-elles besoin pour acquérir un octet de valence.
Liaison non polaire
Une liaison covalente consiste en un partage égal d'une paire d'électrons entre deux atomes. Mais ceci n'est strictement vrai que dans le cas où les deux atomes ont des électronégativités égales; c'est-à-dire la même tendance à attirer la densité électronique de son environnement dans un composite.
Les liaisons non polaires sont caractérisées par une différence d'électronégativité nulle (ΔE≈0). Cela se produit dans deux situations: dans un composé homonucléaire (Adeux), ou si les environnements chimiques des deux côtés de la liaison sont équivalents (H3C-CH3, molécule d'éthane).
Des exemples de liaisons non polaires sont observés dans les composés suivants:
-Hydrogène (H-H)
-Oxygène (O = O)
-Azote (N≡N)
-Fluor (F-F)
-Chlore (Cl-Cl)
-Acétylène (HC≡CH)
Liaisons polaires
Lorsqu'il y a une différence marquée d'électronégativité ΔE entre les deux atomes, un moment dipolaire se forme le long de l'axe de liaison: Aδ+-Bδ-. Dans le cas du composé hétéronucléaire AB, B est l'atome le plus électronégatif, et par conséquent, il a une densité d'électrons δ- plus élevée; tandis que A, le moins électronégatif, déficit de charge δ+.
Pour que les liaisons polaires se produisent, deux atomes avec des électronégativités différentes doivent se joindre; et ainsi former des composés hétéronucléaires. A-B ressemble à un aimant: il a un pôle positif et un pôle négatif. Cela lui permet d'interagir avec d'autres molécules par le biais de forces dipôle-dipôle, parmi lesquelles des liaisons hydrogène..
L'eau a deux liaisons covalentes polaires, H-O-H, et sa géométrie moléculaire est angulaire, ce qui augmente son moment dipolaire. Si sa géométrie était linéaire, les océans s'évaporeraient et l'eau aurait un point d'ébullition plus bas.
Le fait qu'un composé a des liaisons polaires, n'implique pas qu'il est polaire. Par exemple, le tétrachlorure de carbone, CCl4, a quatre liaisons C-Cl polaires, mais en raison de leur disposition tétraédrique, le moment dipolaire finit par être annulé de manière vectorielle.
Liens datifs ou de coordination
Lorsqu'un atome abandonne une paire d'électrons pour former une liaison covalente avec un autre atome, on parle alors d'une liaison dative ou de coordination. Par exemple, avoir B: la paire d'électrons disponible, et A (ou A+), une vacance électronique, le lien B: A est formé.
Dans la structure de la vitamine B12 les cinq atomes d'azote sont liés au centre métallique de Co par ce type de liaison covalente. Ces azotes cèdent leur paire d'électrons libres au cation Co.3+, coordonner le métal avec eux (Co3+: N-)
Un autre exemple peut être trouvé dans la protonation d'une molécule d'ammoniac pour former de l'ammoniac:
H3N: + H+ => NH4+
Notez que dans les deux cas, c'est l'atome d'azote qui apporte les électrons; par conséquent, la liaison covalente dative ou de coordination se produit lorsqu'un atome seul contribue à la paire d'électrons.
De la même manière, la molécule d'eau peut être protonée pour devenir le cation hydronium (ou oxonium):
HdeuxO + H+ => H3OU ALORS+
Contrairement au cation ammonium, l'hydronium a toujours une paire d'électrons libres (H3OU ALORS:+); cependant, il lui est très difficile d'accepter un autre proton pour former la dication hydronium instable, H4OU ALORSdeux+.
-Liaison ionique

Sur la photo, une colline blanche de sel. Les sels se caractérisent par avoir des structures cristallines, c'est-à-dire symétriques et ordonnées; points de fusion et d'ébullition élevés, conductivités électriques élevées lors de la fusion ou de la dissolution, et aussi, ses ions sont fortement liés par des interactions électrostatiques.
Ces interactions constituent ce que l'on appelle la liaison ionique. Dans la deuxième image, un cation A a été montré+ entouré de quatre anions B-, mais c'est une représentation 2D. En trois dimensions, A+ devrait avoir d'autres anions B- en avant et en arrière de l'avion, formant diverses structures.
Ainsi, A+ il peut avoir six, huit ou même douze voisins. Le nombre de voisins entourant un ion dans un cristal est appelé numéro de coordination (N.C). Pour chaque N.C, un type d'arrangement cristallin est associé, qui à son tour constitue une phase solide du sel.
Les cristaux symétriques et facettés observés dans les sels sont dus à l'équilibre établi par les interactions d'attraction (A+ B-) et répulsion (A+ À+, B- B-) électrostatique.
Formation
Mais pourquoi A + et B-, ou Na+ et Cl-, ne forment pas de liaisons covalentes Na-Cl? Parce que l'atome de chlore est beaucoup plus électronégatif que le sodium métallique, qui se caractérise également par l'abandon très facile de ses électrons. Lorsque ces éléments se rencontrent, ils réagissent de manière exothermique pour produire du sel de table:
2Na (s) + Cldeux(g) => 2NaCl (s)
Deux atomes de sodium abandonnent leur seul électron de valence (Na) à la molécule diatomique de Cldeux, pour former les anions Cl-.
Les interactions entre les cations sodium et les anions chlorure, bien qu'ils représentent une liaison plus faible que les covalents, sont capables de les maintenir fortement unis dans le solide; et ce fait se reflète dans le point de fusion élevé du sel (801 ° C).
Lien métallique

Le dernier des types de liaison chimique est métallique. Cela peut être trouvé sur n'importe quelle pièce en métal ou en alliage. Il se caractérise par être spécial et différent des autres, du fait que les électrons ne passent pas d'un atome à un autre, mais voyagent plutôt, comme une mer, à travers le cristal de métaux..
Ainsi, les atomes métalliques, pour dire le cuivre, entremêlent leurs orbitales de valence les unes avec les autres pour former des bandes de conduction; à travers lequel les électrons (s, p, d ou f) passent autour des atomes et les maintiennent étroitement ensemble.
En fonction du nombre d'électrons qui traversent le cristal métallique, des orbitales prévues pour les bandes et de l'empilement de ses atomes, le métal peut être mou (comme les métaux alcalins), dur, brillant ou bon conducteur d'électricité et chaud.
La force qui maintient ensemble les atomes de métaux, tels que ceux qui composent le petit homme de l'image et son ordinateur portable, est plus grande que celle des sels.
Ceci peut être vérifié expérimentalement car les cristaux des sels peuvent être divisés en plusieurs moitiés avant une force mécanique; tandis qu'une pièce métallique (constituée de très petits cristaux) est déformée.
Exemples de liens
Les quatre composés suivants englobent les types de liaisons chimiques expliqués:
-Fluorure de sodium, NaF (Na+F-): ionique.
-Sodium, Na: métallique.
-Fluor, Fdeux (F-F): covalente non polaire, du fait qu'il y a un ΔE nul entre les deux atomes car ils sont identiques.
-Fluorure d'hydrogène, HF (H-F): covalent polaire, car dans ce composé le fluor est plus électronégatif que l'hydrogène.
Il existe des composés, comme la vitamine B12, possédant à la fois des liaisons covalentes polaires et ioniques (dans la charge négative de son groupe phosphate -PO4--). Dans certaines structures complexes, telles que les clusters métalliques, tous ces types de liens peuvent même coexister.
La matière offre dans toutes ses manifestations des exemples de liaisons chimiques. De la pierre au fond d'un étang et de l'eau qui l'entoure, aux crapauds qui croassent sur ses bords.
Bien que les liaisons puissent être simples, le nombre et la disposition spatiale des atomes dans la structure moléculaire font place à une riche diversité de composés..
Importance de la liaison chimique
Quelle est l'importance de la liaison chimique? Le nombre incalculable de conséquences que déclencherait l'absence de liaison chimique met en évidence son énorme importance dans la nature:
-Sans elle, les couleurs n'existeraient pas, car ses électrons n'absorberaient pas le rayonnement électromagnétique. La poussière et les particules de glace présentes dans l'atmosphère disparaîtraient, et donc la couleur bleue du ciel deviendrait sombre..
-Le carbone ne pouvait pas former ses chaînes sans fin, dont dérivent des billions de composés organiques et biologiques.
-Les protéines ne pouvaient même pas être définies dans leurs acides aminés constitutifs. Les sucres et les graisses disparaîtraient, ainsi que tous les composés de carbone dans les organismes vivants.
-La Terre serait laissée sans atmosphère, car en l'absence de liaisons chimiques dans ses gaz, il n'y aurait aucune force pour les maintenir ensemble. Il n'y aurait pas non plus la moindre interaction intermoléculaire entre eux.
-Les montagnes pourraient disparaître, car leurs roches et minéraux, bien que lourds, ne pouvaient pas contenir leurs atomes entassés à l'intérieur de leurs structures cristallines ou amorphes..
-Le monde serait composé d'atomes solitaires incapables de former des substances solides ou liquides. Cela entraînerait également la disparition de toute transformation de la matière; c'est-à-dire qu'il n'y aurait pas de réaction chimique. Juste des gaz fugaces partout.
Les références
- Harry B. Gray. (1965). Electrons et liaison chimique. WASHINGTON. BENJAMIN, INC. P 36-39.
- Whitten, Davis, Peck et Stanley. Chimie. (8e éd.). Apprentissage CENGAGE, p 233, 251, 278, 279.
- Nave R. (2016). Une liaison chimique. Récupéré de: hyperphysics.phy-astr.gsu.edu
- Types de liaisons chimiques. (3 octobre 2006). Tiré de: dwb4.unl.edu
- Formation de liaisons chimiques: le rôle des électrons. [PDF]. Récupéré de: cod.edu
- Fondation CK-12. (s.f.). Énergie et formation de liaisons covalentes. Récupéré de: chem.libretexts.org
- Quimitube. (2012). Liaison covalente coordonnée ou dative. Récupéré de: quimitube.com


Personne n'a encore commenté ce post.